Odisha State Board BSE Odisha 9th Class Physical Science Notes Chapter 4 ପରମାଣୁ ଗଠନ will enable students to study smartly.
BSE Odisha Class 9 Physical Science Notes Chapter 4 ପରମାଣୁ ଗଠନ
→ ପରିଚୟ (Introduction):
(i) ଡାଲ୍ନ୍ଙ୍କ ପରମାଣୁ ତତ୍ତ୍ବ ଅନୁଯାୟୀ, ‘‘ପରମାଣୁ ହେଉଛି ମୌଳିକର କ୍ଷୁଦ୍ରତମ, ଅବିଭାଜ୍ୟ, ଅବିଧ୍ୱଂସୀ କଣିକା ଏବଂ ଏହି କଣିକାଟି ରାସାୟନିକ ପରିବର୍ତ୍ତନରେ ଅଂଶ ଗ୍ରହଣ କରିଥାଏ ।
(ii) ଊନବିଂଶ ଶତାବ୍ଦୀରେ ପଦାର୍ଥର ବୈଦ୍ୟୁତିକ ପ୍ରକୃତିକୁ ଭିଭିକରି ବୈଜ୍ଞାନିକମାନେ ମତଦେଲେ ଯେ, ପରମାଣୁ କ୍ଷୁଦ୍ରତମ କଣିକା ନୁହେଁ, ପରମାଣୁ ମଧ୍ଯରେ କ୍ଷୁଦ୍ରତର କଣିକା ବା ଇଲେକ୍ଟ୍ରନ, ପ୍ରୋଟନ ଓ ନିଉଟ୍ରନ ପରି ଅବପରମାଣୁ କଣିକା (Subatomic particles) ଦ୍ଵାରା ଗଠିତ । ଏହି କଣିକାଗୁଡ଼ିକୁ
→ ପରମାଣୁର ଗଠନ (Structure of an Atom) :
(i) ପରମାଣୁ ଭିତରେ ଇଲେକ୍ଟ୍ରନ୍ ଓ ପ୍ରୋଟନ୍ ଗୁଡ଼ିକ କିପରି ସଜ୍ଜିତ ହୋଇ ରହିଛନ୍ତି ତାହା ଜାଣିବାପାଇଁ ଏବଂ ଏହାକୁ ବୁଝାଇବା ପାଇଁ ଅନେକ ବୈଜ୍ଞାନିକ ବିଭିନ୍ନ ପରମାଣୁ ମଡ଼େଲ ପ୍ରସ୍ତାବ କରିଥିଲେ ।
(ii) ବୈଜ୍ଞାନିକ ଜେ.ଜେ. ଟମସନ୍ ସର୍ବପ୍ରଥମେ ପରମାଣୁ ଗଠନର ଏକ ମଡ଼େଲର ପ୍ରସ୍ତାବ ଦେଇଥିଲେ ।
![]()
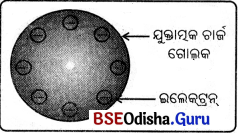
→ ଥୋମସନ୍ ର ପରମାଣୁର ମଡେଲ୍ (Thomson’s Model of an Atom):
(i) ଟମ୍ସନ୍ ଙ୍କ ପରମାଣୁ ମଡ଼େଲ ଅନୁ ଯାୟୀ ପରମାଣୁଟି ଯୁକ୍ତାତ୍ମକ ଚାର୍ଜ ରହିଥିବା ଏକ ଗୋଲକ । ଇଲେକ୍ଟ୍ରଗୁଡ଼ିକ ଏହା ଭିତରେ ବାଣ୍ଟି ହୋଇ ରହିଥା’ନ୍ତି ।
(ii) ପରମାଣୁର ଯୁକ୍ତାତ୍ମକ ଚାର୍ଜ ବିସ୍ତାରିତ ହୋଇଥିବା ବେଳେ ପରମାଣୁରେ ଇଲେକ୍ଟ୍ରନ୍ ଗୁଡ଼ିକ ବିଚ୍ଛୁରିତ ହୋଇ ରହିଥାନ୍ତି ।
ଟମସନ୍ଙ୍କ ପ୍ରସ୍ତାବ ଅନୁ ସାରେ :
(i) ପରମାଣୁ ଏକ ଯୁକ୍ତାତ୍ମକ ଚାର୍ଜ ଧାରଣ କରିଥିବା ଗୋଲକ ଏବଂ ଏଥିରେ ଇଲେକ୍ଟ୍ରଗୁଡ଼ିକ ସବୁଆଡ଼େ ଦୃଢ଼ଭାବରେ ସଂଯୁକ୍ତ ହୋଇ ରହିଥା’ନ୍ତି ।
(ii) ପରମାଣୁରେ ଯୁକ୍ତାତ୍ମକ ଚାର୍ଜ ଓ ବିଯୁକ୍ତାତ୍ମକ ଚାର୍ଜ ସମାନ ପରିମାଣରେ ଥାଏ । ତେଣୁ ପରମାଣୁଟି ବିଦ୍ୟୁତ୍ ନିରପେକ୍ଷ (neutral) ।
→ ରଥରଫୋର୍ଡର ଏକ ପରମାଣୁର ମଡେଲ୍ । (Rutherford’s Model of an Atom) : ବୈଜ୍ଞାନିକ ରଦରଫୋର୍ଡ଼ ଏକ ପରୀକ୍ଷାର ପରିକଳ୍ପନା କରିଥିଲେ । ଏହି ପରୀକ୍ଷାରେ ଖଣ୍ଡିଏ ଅତି ପତଳା ସୁନାପାତିଆ ଉପରେ ତୀବ୍ର ବେଗରେ ଗତି କରୁଥିବା α କଣିକାକୁ ନିକ୍ଷେପ କରାଗଲା । α, କଣିକା ହେଉଛି । ହିଲିୟମ୍ ଆୟନ (He++) ଯାହା ଦ୍ଵି ଯୁକ୍ତାତ୍ମକ ଚାର୍ଜ (++) ବହନ କରେ ଏବଂ ଏହାର ବସ୍ତୁତ୍ଵ 4u ହୋଇଥିବାରୁ ଏଥିରେ ଯଥେଷ୍ଟ ପରିମାଣରେ ଶକ୍ତି ରହିଥାଏ।
ପର୍ଯ୍ୟବେକ୍ଷଣ :
(i) ଅଧିକାଂଶ -କଣିଳା ସନାପାନିଆ ମଧ୍ୟଦେଇ ସାଧାସଳଖ ଭାବରେ ଗତକଲା
(ii) କିଛି α-କଣିକାର ଗତିପଥ ବଙ୍କେଇ ହୋଇଗଲା ।
(iii) ଅଳ୍ପକିଛି α-କଣିକା ସୁନାପାତିଆକୁ ଭେଦ ନକରି ଯେଉଁ ଦିଗରେ ଯାଇଥିଲା ଠିକ୍ ତା’ର ବିପରୀତ ଦିଗରେ ପଛକୁ ଫେରିଆସଲା
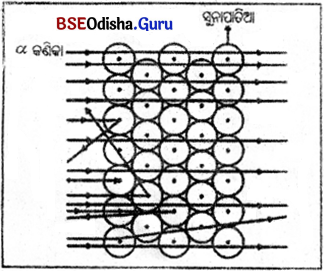
ସିଦ୍ଧାନ୍ତ :
(i) ଅଧିକାଂଶ α- କ ଣିକ। ସୁନା ପାତିଆ ମଧ୍ୟଦେଇ ଗଳି ଯାଉଥ୍ ବା ରୁ ଭିତରେ ଅସ୍ଵୀକାଂଶ ସ୍ଥାନ ଫମ୍ପା (empty) ।
(ii) ଖୁବ୍ କମ୍ ସଂଖ୍ୟକ α-କଣିକା ଗତିପଥରେ ବଙ୍କାଇ ଯାଉଥିବାରୁ ପରମାଣୁର ଯୁକ୍ତାତ୍ମକ ଚାର୍ଜ କମ୍ ସ୍ଥାନ ଦଖଲ କରିଛି ।
(iii) ଅତି ଅଳ୍ପ ନଂ-କଣିକା ସୁନାପାତିଆକୁ ଭେଦକରି ନପାରି ପଛକୁ ଫେରିଆସିବାରୁ ସୂଚନା ମିଳୁଛି ଯେ, ସୁନା ପରମାଣୁର ସମସ୍ତ ଯୁକ୍ତାତ୍ମକ ଚାର୍ଜ ଓ ବସ୍ତୁତ୍ଵ କେନ୍ଦ୍ରୀଭୂତ ହୋଇ ପରମାଣୁ ମଧ୍ୟରେ ଖୁବ୍ କମ୍ ସ୍ଥାନ ଆଧ୍କାର କରିଛି ।
![]()
ରଦରଫୋର୍ଡ଼ଙ୍କ ପ୍ରସ୍ତାବ ଅନୁସାରେ :
(i) ପରମାଣୁରେ ଏକ ଯୁକ୍ତାତ୍ମକ ଚାର୍ଜିତ କେନ୍ଦ୍ର ରହିଛି, ଯାହାକୁ ନ୍ୟୁକ୍ଲିୟସ୍ କୁହାଯାଏ । ପରମାଣୁର ପ୍ରାୟ ସମସ୍ତ ବସ୍ତୁତ୍ଵ ଏହି ନ୍ୟୁକ୍ଲିୟସ୍ରେ କେନ୍ଦ୍ରୀଭୂତ ହୋଇ ରହିଛି । ନ୍ୟୁକ୍ଲିୟସ୍ ଚାରିପଟେ ବହୁତ ଫାଙ୍କା
(ii) ଇଲେକ୍ଟ୍ରଗୁଡ଼ିକ ନ୍ୟୁକ୍ଲିୟସ୍ ଚାରିପଟେ ଥିବା ଫାଙ୍କା ସ୍ଥାନରେ ନିର୍ଦ୍ଦିଷ୍ଟ କକ୍ଷପଥରେ ଘୂରନ୍ତି ।
(iii) ପରମାଣୁର ଅକାର ତୁଳନାରେ ନ୍ୟୁକ୍ଲିୟସ୍ର ଆକାର ଖୁବ୍ ଛୋଟ ।
→ ରଥରଫୋର୍ଡର ମଡେଲର ପରମାଣୁର ତ୍ରୁଟି (Drawbacks of Rutherford’s Model of Atom):
(i) ପରମାଣୁ ମଧ୍ୟରେ ନ୍ୟୁକ୍ଲିୟସ୍ ଚାରିପଟେ ଘୂର୍ଣ୍ଣନ କରୁଥିବା ଇଲେକ୍ଟ୍ରନ୍ ତ୍ଵରଣ ଥିବାରୁ ଘୂର୍ଣ୍ଣନରତ ଇଲେକ୍ଟ୍ରନ୍ ଏକ ତ୍ଵରାନ୍ଵିତ ଚାର୍ଜିତ କଣିକା ।
(ii) ତ୍ଵରାନ୍ଵିତ ଚାର୍ଜିତ କଣିକାରୁ ଶକ୍ତି ବିକିରଣ ହୁଏ । ତେଣୁ ପରମାଣୁ ଭିତରେ ନ୍ୟୁକ୍ଲିୟସ୍ ଚାରିପଟେ ଘୂରି ବୁଲୁଥିବା ଇଲେକ୍ଟ୍ରନ୍ରୁ ଅନବରତ ଶକ୍ତି ବିକିରିତ ହେବା ଆଶା କରାଯାଏ । ଫଳରେ ଇଲେକ୍ଟ୍ରନ୍ର ଶକ୍ତିସ୍ତର ଅନବରତ ହ୍ରାସ ପାଇବ ।
(iii) ଏହି କାରଣରୁ ଇଲେକ୍ଟ୍ରନ୍ ବୃତ୍ତାକାର କକ୍ଷପଥରେ ନ ଘୂରି କୁଣ୍ଡଳାୟିତ ପଥରେ ଘୂରି ଘୂରି ଶେଷରେ ନ୍ୟୁକ୍ଲିୟସ୍ରେ ମିଶିଯିବ । ଏହାଦ୍ଵାରା ଇଳେକ୍ଟ୍ରନ୍ ବର୍ଭୁଳପଥରେ ସ୍ଥାୟୀ ହୋଇ ରହିବ ନାହିଁ ।
(iv) ମାତ୍ର ଇଲେକ୍ଟ୍ରନ୍ ପରମାଣୁ ମଧ୍ୟରେ କୁଣ୍ଡଳାୟିତ ପଥରେ ଘୂରି ଘୂରି ନ୍ୟୁକ୍ଲିୟସରେ ମିଶିଯାଏ ନାହିଁ । ରଦରଫୋର୍ଡ଼ ଏହାର କାରଣ ବୁଝାଇପାରିଲେ ନାହିଁ ।
→ ବୋ’ରଙ୍କ ପରମାଣୁ ମଡ଼େଲ (Bohr’s Model of Atom):
ରଦରଫୋର୍ଡ଼ଙ୍କ ମଡ଼େଲରେ ଥିବା ତ୍ରୁଟିକୁ ଦୂର କରିବାପାଇଁ 1913 ମସିହାରେ ବୈଜ୍ଞାନିକ ବୋ’ର ଏକ ନୂଆ ପରମାଣୁ ମଡ଼େଲ ଉପସ୍ଥାପନ କଲେ । ବୋ’ରଙ୍କ ପରମାଣୁ ମଡ଼େଲର ରଦରଫୋର୍ଡ଼ଙ୍କ ପରମାଣୁ ମଡ଼େଲ ସହିତ ଅନେକ ସାମଞ୍ଜସ୍ୟ ଥିଲା । ବୋ’ରଙ୍କ ମଡ଼େଲ୍ ଅନୁ ସାରେ ଏକ ଯକ୍ତା ମକ କେନ୍ଦ୍ର ସ୍ଥଳୀ ଥାଏ. ଏକ ଯୁକ୍ତାତ୍ମକ କେନ୍ଦ୍ର ସ୍ଥଳୀ ଥାଏ, ଯାହାକୁ ନ୍ୟୁକ୍ଲିୟସ୍ କୁହାଯାଏ । ନ୍ୟୁକ୍ଲ ୟସ୍ ଚାରି ପଟେ ଥିବ । ଶୂନ୍ୟସ୍ଥାନରେ ଇଲେକ୍ ଟ୍ରନ୍ ଗୁଡ଼ିକ କେ ବ ଳ କେ ତେ ଗୁ ଡ଼ିଏ ନି ର୍ଦ୍ଦିଷ୍ଟ କେତେ ବର୍ଭୁ ଳାକାର କକ୍ଷପଥରେ ନ୍ୟୁକ୍ଲିୟସ୍ଚାରିପଟେ ଘୂର୍ଣ୍ଣନ କରନ୍ତି ।’’
ବୋ’ରଙ୍କ ସ୍ଵୀକାର :
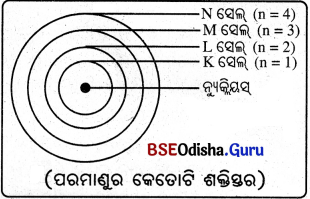
(i) ନ୍ୟୁକ୍ଲିୟସ୍ ଚାରିପଟେ କେବଳ କେତେକ ନିର୍ଦ୍ଦିଷ୍ଟ କକ୍ଷପଥରେ ଇଲେକ୍ଟ୍ରଗୁଡ଼ିକ ଘୂର୍ଣ୍ଣନ କରେ ।
(ii) କ କ୍ଷ ପଥରେ ଘୂରୁ ଥ୍ ବି । ବେ ଳେ ନିର୍ଦିଷ୍ଠ କପଥରେ ଘୁରୁଥ୍ଚାବେ କେ ଇଲେକ୍ଟ୍ରଗୁଡ଼ିକ ଶକ୍ତି ବିକିରଣ କରନ୍ତି ନାହିଁ । ତେଣୁ ସେହି କକ୍ଷପଥକୁ ବିକିରଣବିହୀନ (non-radiating) କକ୍ଷ କୁହାଯାଏ ।
(iii) ଏହି କକ୍ଷପଥ ବା ସେଲ୍ (shell) ଗୁଡ଼ିକୁ ଶକ୍ତିସ୍ତର (energy level) କୁହାଯାଏ ।
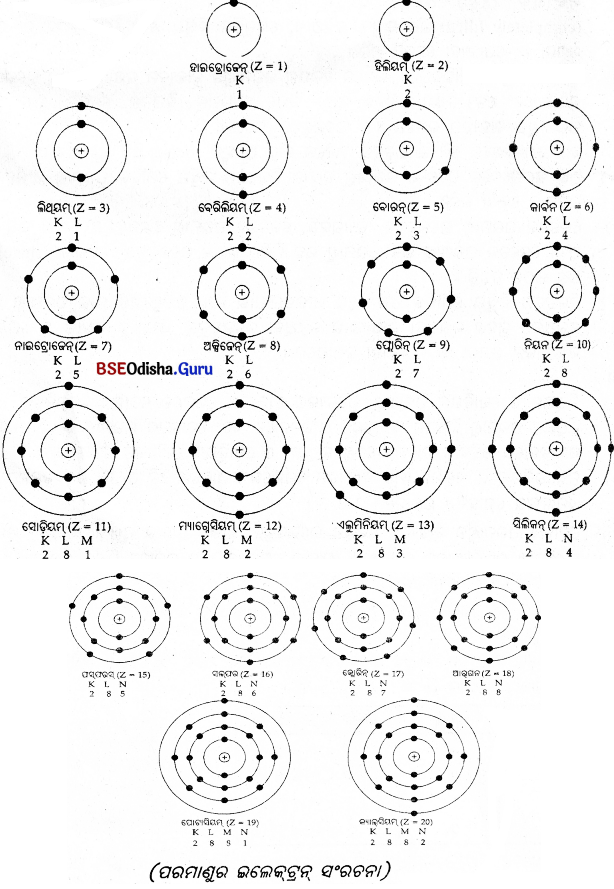
(iv) କକ୍ଷପଥ ବା ସେଲ୍ଗୁଡ଼ିକୁ ନ୍ୟୁକ୍ଲିୟସ୍ଠାରୁ ଦୂରତା କ୍ରମରେ ଯଥାକ୍ରମେ K, L, M, N ଇତ୍ୟାଦି ଅକ୍ଷରଦ୍ଵାରା ବା 1, 2, 3, 4 ଇତ୍ୟାଦି ସଂଖ୍ୟାଦ୍ଵାରା ସୂଚିତ କରାଯାଏ ।
→ ନିଉଟ୍ରନ୍ (Neutron):
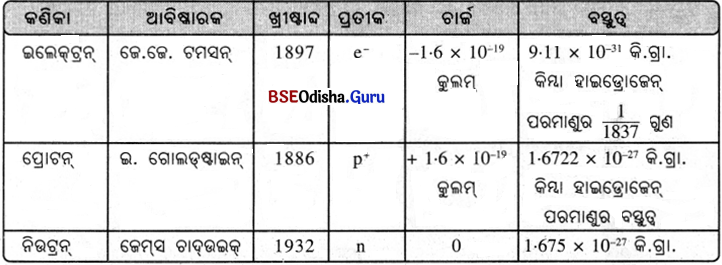
(i) 1932 ମସିହାରେ ବ୍ରିଟିଶ୍ ବୈଜ୍ଞାନିକ ଜେମ୍ସ ଚାଦଉଇକ୍ ପରମାଣୁ ଭିତରେ ଥିବା ‘ନିଉଟ୍ରନ୍’ କଣିକାର ଆବିଷ୍କାର କରିଥିଲେ ।
(ii) ନିଉଟ୍ରନ୍ ଚାର୍ଜବିହୀନ ଏବଂ ଏହାର ବସ୍ତୁତ୍ଵ ପ୍ରୋଟନ୍ର ବସ୍ତୁତ୍ଵ ସହ ପ୍ରାୟ ସମାନ ।
(iii) ହାଇଡ୍ରୋଜେନ୍ ବ୍ୟତୀତ ଅନ୍ୟସବୁ ପରମାଣୁର ନ୍ୟୁକ୍ଲିୟସ୍ ଭିତରେ ନିଉଟ୍ରନ୍ ରହିଥାଏ ।
(iv) ପ୍ରୋଟନ୍ ବା ନିଉଟ୍ରନ୍ର ବସ୍ତୁତ୍ଵ ତୁଳନାରେ ଇଲେକ୍ଟ୍ରିନ୍ର ବସ୍ତୁତ୍ଵ ନଗଣ୍ୟ
![]()
ପରମାଣୁରେ ଥିବା ମୁଖ୍ୟ କଣିକାର ପ୍ରତୀକ, ଚାର୍ଜ ଓ ବସ୍ତୁତ୍ଵ
କଷପଥ ମଧ୍ୟରେ ଇକେକ୍ଟ୍ରନ୍ ମାନଙ୍କର ସଜ୍ଵ ।
ପରମାଣୁର ବିଭିନ୍ନ କକ୍ଷପଥରେ ଇଲେକ୍ଟ୍ରନ୍ ଗୁଡ଼ିକ କିପରି ବାଣ୍ଟିହୋଇ ରହିବେ, ତାହା ବୋ’ର ଏବଂ ବରି ପ୍ରସ୍ତାବ ଦେଇଥିଲେ ।
(i) କୌଣସି ସେଲ୍ରେ ରହୁଥିବା ସର୍ବାଧିକ ଇଲେକ୍ଟ୍ରନ୍ ସଂଖ୍ୟା 2n2 ଅଟେ । n ହେଉଛି କକ୍ଷମାନଙ୍କର କ୍ରମିକ ସଂଖ୍ୟା ବା ଶକ୍ତିସ୍ତର ସୂଚନାଙ୍କ (n = 1, 2, 3…) ।
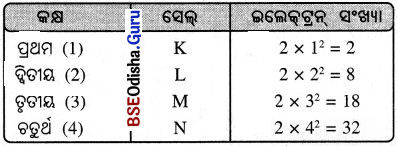
(ii) ପରମାଣୁର ବାହ୍ୟତମ କକ୍ଷରେ ସର୍ବାଧିକ 8ଟି ଇଲେକ୍ଟ୍ରନ୍ ରହିପାରିବ । ଯଦି ଗୋଟିଏ ପରମାଣୁର ତୃତୀୟ କକ୍ଷଟି ବାହ୍ୟତମ କକ୍ଷ ହୋଇଥାଏ, ତେବେ ସେଥିରେ ୫ଟିରୁ ଅଧୂକ ଇଲେକ୍ଟ୍ରନ୍ ରହିପାରିବ ନାହିଁ । ଚତୁର୍ଥ କକ୍ଷ ଯଦି ବାହ୍ୟତମ କକ୍ଷ ହୁଏ, ତେବେ ସେଥିରେ ମଧ୍ୟ ୫ଟି ଇଲେକ୍ଟ୍ରନ୍ ରୁ ଅଧିକ ରହିବ ନାହିଁ।
→ ସଂଯୋଜକ ଇଲେକ୍ଟ୍ରନ୍ (Valency Electron) :
(i) ଯେଉଁ ମୌଳିକଗୁଡିକର ପରମାଣୁର ବାହ୍ୟତମ ସେଲ୍ରେ ସର୍ବା ଧୂକ (୫ଟି) ଅର୍ଥାତ୍ ସଂପୂର୍ଣ୍ଣ ମାତ୍ରା । ରେ (completely filled) ଇଲେକ୍ଟ୍ରନ୍ ରହିଥାଏ, ସେଗୁଡ଼ିକ ନିଷ୍କ୍ରିୟ ଏବଂ ସେମାନଙ୍କର ସଂଯୋଜନ କ୍ଷମତା ବା ଯୋଗ୍ଯତା ହେଉଛି ଶୂନ ।
(ii) ଏହିପରି ନିଷ୍କ୍ରିୟ ମୌଳିକଗୁଡ଼ିକ ମଧ୍ୟରେ ହିଲିୟମ୍ ପରମାଣୁର ବାହ୍ୟତମ କକ୍ଷରେ ଦୁଇଟି ଇଲେକ୍ଟ୍ରନ୍ ରହିଛି ଏବଂ ଅନ୍ୟ ନିଷ୍କ୍ରିୟ ମୌଳିକ; ଯଥା-ନିୟନ, ଆରଗନ୍, କ୍ରିପ୍ଟନ୍, ଜେନନ୍, ରାଡ଼ନ୍ ଆଦି ପରମାଣୁର ବାହ୍ୟତମ କକ୍ଷରେ 8 ଟି ଇଲେକ୍ଟ୍ରନ୍ ରହିଥାଏ ।
(iii) ବାହ୍ୟତମ କକ୍ଷରେ ୫ଟି ଇଲେକ୍ଟ୍ରିନ୍ ରହିଲେ ତାକୁ ଅଗ୍ନେଟ (octet) ସ୍ଥିତି କୁହାଯାଏ ।
(iv) ଅଣୁ ଗଠନବେଳେ ପ୍ରତ୍ୟେକ ପରମାଣୁ ତାହାର ନିକଟତମ ନିଷ୍କ୍ରିୟ ମୌଳିକ ପରମାଣୁ ସଂରଚନାରେ ରହିବାକୁ ଚେଷ୍ଟା କରେ ।
କେତେକ ପରମାଣୁ ଇଲେକ୍ଟ୍ରନ୍ ତ୍ୟାଗକରି, କେତେକ ପରମାଣୁ ଇଲେକ୍ଟ୍ରନ୍ ଗ୍ରହଣ କରି ଏବଂ ଅନ୍ୟ କେତେକ ପରମାଣୁ ଭିନ୍ନ ପରମାଣୁ ସହ ମିଳିତ ଭାବେ ଇଲେକ୍ଟ୍ରନ୍ ସହଭାଗ (share) କରି ଅଣୁ ଗଠନ କରନ୍ତି ।
(vi) ନିକଟତମ ନିଷ୍କ୍ରିୟ ମୌଳିକ ପରମାଣୁର ସଂରଚନାପାଇଁ କିମ୍ବା ଅକ୍ଟିସ୍ଥିତି ପାଇଁ ପରମାଣୁ ତ୍ୟାଗ କରୁଥିବା, ଗ୍ରହଣ କରୁଥିବା କିମ୍ବା ଭାଗ କରୁଥିବା ଇଲେକ୍ଟ୍ରମ୍ ସଂଖ୍ୟାରୁ ସିଧାସଳଖ ମୌଳିକର ସଂଯୋଜନ କ୍ଷମତା ବା ଯୋଗ୍ୟତା ଜଣାପଡ଼େ ।
![]()
ଉଦାହରଣ :
(a) ଲିଥ୍ୟମ୍ ଓ ସୋଡ଼ିୟମ୍ ପରମାଣୁ ପ୍ରତ୍ୟେକର’ ବାହ୍ୟତମ ସେଲ୍ରେ ଗୋଟିଏ ଇଲେକ୍ଟ୍ରିନ୍ ଥାଏ । ଲିଥୁମ୍ ପରମାଣୁ ହିଲିୟମ୍ ପରମାଣୁର ସଂରଚନାରେ ଏବଂ ସୋଡ଼ିୟମ୍ ପରମାଣୁ ନିୟନ ପରମାଣୁର ସଂରଚନାରେ ରହିବାକୁ ଚାହେଁ । ତେଣୁ ଲିଥୁମ୍ ଓ ସୋଡ଼ିୟମ୍ ମୌଳିକର ଯୋଗ୍ୟତା । ।
(b) ମ୍ୟାଗ୍ନେସିୟମ୍ ଓ ଏଲୁମିନିୟମ୍ର ବାହ୍ୟତମ ସେଲ୍ରେ ଯଥାକ୍ରମେ 2ଟି ଓ 3ଟି ଇଲେକ୍ଟ୍ରନ୍ ଥୁବାରୁ ଏମାନଙ୍କର ଯୋଗ୍ୟତା ଯଥାକ୍ରମେ 2 ଓ 3 ।
(vii) ଗୋଟିଏ ପରମାଣୁର ବାହ୍ୟତମ ସେଲ୍ର ଇଲେକ୍ଟ୍ରନ୍ ସଂଖ୍ୟା ତାହାର ପୂର୍ଣ୍ଣ (ସର୍ବାଧିକ) କ୍ଷମତାର ପାଖାପାଖୁ ବା ନିକଟତର ହୋଇଥାଏ, ତାହାର ଯୋଗ୍ୟତା ଭିନ୍ନ ପ୍ରକାରେ ନିର୍ଣ୍ଣୟ କରାଯାଏ ।
ଉଦାହରଣ :
କ୍ଲୋରିନ୍ ପରମାଣୁର ବାହ୍ୟତମ ସେଲ୍ରେ 7ଟି ଇଲେକ୍ଟ୍ରନ୍ ଅଛି । କ୍ଲୋରିନ୍ ପାଇଁ 7ଟି ଇଲେକ୍ଟ୍ରନ୍ ତ୍ୟାଗ କରିବା ଅପେକ୍ଷା ଗୋଟିଏ ଇଲେକ୍ଟ୍ରନ୍ ଗ୍ରହଣ କରିବା ସହଜ ହୋଇଥାଏ । ତେଣୁ ଅକ୍ଟେଟ୍ (8)ରୁ 7ଟି ଇଲେକ୍ଟ୍ରନ୍ ବିୟୋଗ କରି ଏହାର ଯୋଗ୍ୟତା ନିର୍ଣ୍ଣୟ କରାଯାଏ । ତେଣୁ କ୍ଲୋରିନ୍ର ଯୋଗ୍ୟତା l ହୋଇଥାଏ । ସେହିପରି ଅକ୍ସିଜେନ୍ର ଯୋଗ୍ୟତା 2 ଅଟେ ।
(viii) ପ୍ରତ୍ୟେକ ମୌଳିକର ପରମାଣୁର ଏକ ନିର୍ଦ୍ଦିଷ୍ଟ ସଂଯୋଜନ କ୍ଷମତା ରହିଛି । ଏହାକୁ ମୌଳିକର ଯୋଗ୍ଯତା
କୁହାଯାଏ ।
→ ପରମାଣୁ କ୍ରମାଙ୍କ (Atomic Number):
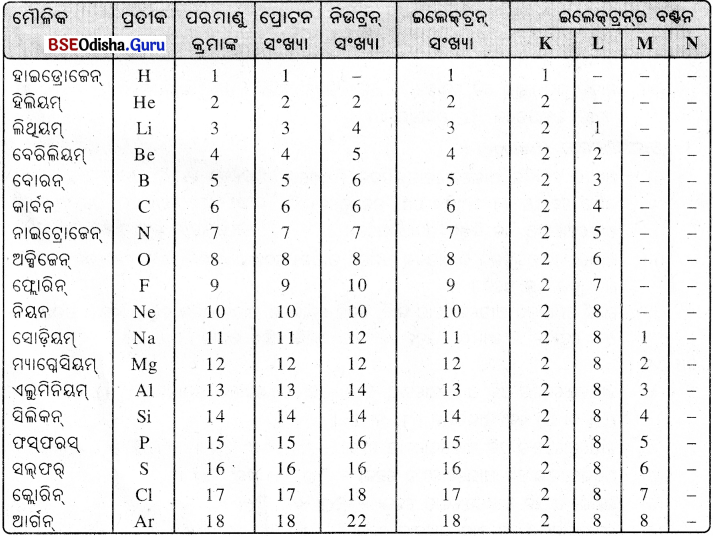
(i) ବିଭିନ୍ନ ପ୍ରକାର ପରମାଣର ନ୍ୟୁକ୍ଲିୟସରେ ପ୍ରୋଟନ ସଂଖ୍ୟା ଭିନ୍ନ ଭିନ୍ନ ହୋଇଥାଏ ।
(ii) ପରମାଣୁ କ୍ରମାଙ୍କକୁ Z ଦ୍ଵାରା ସୂଚିତ କରାଯାଏ ।
(iii) ପ୍ରତ୍ୟେକ ମୌଳିକର କେବଳ ଗୋଟିଏ ପରମାଣୁ କ୍ରମାଙ୍କ ଥାଏ I
![]()
ଉଦାହରଣ :
(a) ହାଇଡ୍ରୋଜେନ୍ ପରମାଣୁର ନ୍ୟୁକ୍ଲିୟସ୍ରେ କେବଳ ଗୋଟିଏ ପ୍ରୋଟନ୍ ଥିବାରୁ ତାହାର ପରମାଣୁ କ୍ରମାଙ୍କ । ।
(b) କାର୍ବନ ପରମାଣୁର ନ୍ୟୁକ୍ଲିୟସ୍ରେ ଟେ ପ୍ରୋଟନ୍ ଥିବାରୁ କାର୍ବନର ପରମାଣୁ କ୍ରମାଙ୍କ 6 ।
ବିଭିନ୍ନ – ସେଲ୍ରେ ଇଲେକ୍ଟ୍ରନ୍ ବଣ୍ଟନ ସହ ପ୍ରଥମ କେତୋଟି ମୌଳିକର ପରମାଣୁ ଗଠନ
→ ବସ୍ତୁତ୍ୱ ସଂଖ୍ୟା (Mass Number) :
(i) ପରମାଣୁ ମଧ୍ୟରେ ପ୍ରୋଟନ୍, ନିଉଟ୍ରନ୍ ଓ ଇଲେକ୍ଟ୍ରିନ୍ ଥାଏ । ପ୍ରୋଟନ୍ ବା ନିଉଟ୍ରନ୍ର ବସ୍ତୁତ୍ଵ ତୁଳନାରେ ଇଲେକ୍ଟ୍ରିନ୍ର ବସ୍ତୁତ୍ଵ ନଗଣ୍ୟ ହୋଇଥିବାରୁ ପରମାଣୁର ବସ୍ତୁତ୍ଵ ନିଶ୍ଚୟ କଲାବେଳେ ଅନେକ କ୍ଷେତ୍ରରେ ଇଲେକ୍ଟ୍ରିନ୍ର ବସ୍ତୁତ୍ୱକୁ ଉପେକ୍ଷା କରାଯାଏ ।
(ii) ପରମାଣୁର ନ୍ୟୁକ୍ଲିୟସ୍ରେ ରହିଥିବାରୁ ପ୍ରୋଟନ୍ ଓ ନିଉଟ୍ରନ୍କୁ ନ୍ୟୁକ୍ଲିୟନ୍ (Neucleon) କୁହାଯାଏ ।
(iii) ପରମାଣୁର ବସ୍ତୁତ୍ଵ ଏହାର ନ୍ୟୁକ୍ଲିୟସ୍ରେ ନିହିତ ଥାଏ ।
![]()
ଉଦାହରଣ :
(a) ନାଇଟ୍ରୋଜେନ୍ର ପ୍ରୋଟନ୍ ସଂଖ୍ୟା = 7 ଓ ନ୍ୟୁଟ୍ରନ୍ ସଂଖ୍ୟା = 7
∴ ନାଇଟ୍ରୋଜେନ୍ ର ବସ୍ତୁତ୍ଵ = 7u + 7u = 14u
(b) ସୋଡ଼ିୟମ୍ର ପ୍ରୋଟନ୍ ସଂଖ୍ୟା = 11 ଓ ନିଉଟ୍ରନ୍ ସଂଖ୍ୟା = 12
∴ସୋଡ଼ିୟମ୍ର ବସ୍ତୁତ୍ଵ = 11u + 12u = 23u
(v) ଗୋଟିଏ ପରମାଣୁ ପାଇଁ ସଙ୍କେତନ (notation) ରେ ମୌଳିକର ପରମାଣୁ କ୍ରମାଙ୍କ, ବସ୍ତୁତ୍ୱ ସଂଖ୍ୟା ଓ ପ୍ରତୀକ ନିମ୍ନ ପ୍ରକାରେ ପ୍ରକାଶ କରାଯାଏ ।
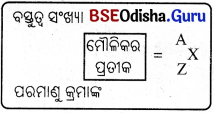
ଉଦାହରଣ :
(a) ସୋଡ଼ିୟମକୁ 2311Na ରୂପେ ପ୍ରକାଶ କରାଯାଏ । ଏଥୁରୁ ବୁଝାଯାଏ ସୋଡ଼ିୟମ୍ର ପରମାଣୁ କ୍ରମାଙ୍କ 11 ଓ ବସ୍ତୁତ୍ୱ ସଂଖ୍ୟା 23 1
(b) କାର୍ବନ ପରମାଣୁର ଟି ପ୍ରୋଟନ୍ ଓ ଟିଂ ନିଉଟ୍ରନ୍ ରହିଛି । ତେଣୁ କାର୍ବନର ବସ୍ତୁତ୍ଵ ସଂଖ୍ୟା 12 । ଏହାକୁ ସଂକ୍ଷେପରେ 126C ଲେଖାଯାଏ ।
ଏ ଆଇସୋଟୋପ୍ (Isotope) :
(i) ଅନେକ ମୌଳିକ ଆଜସେ ଟେ। ପଗୁଡ଼ିକର ମିଶ୍ରଣରେ ଗଠିତ ହୋଇଥାଏ । ଗୋଟିଏ ମୌଳିକର ପ୍ରତ୍ୟେକଟି ଆଇସୋଟୋପ୍ ଏକ ବିଶୁଦ୍ଧ ପଦାର୍ଥ ଅଟେ ।
(ii) ଆଇସୋଟୋପ୍ଗୁଡ଼ିକର ରାସାୟନିକ ଧର୍ମରେ ପାର୍ଥକ୍ୟ ଦେଖାଯାଏ ନାହିଁ, କିନ୍ତୁ ସେମାନଙ୍କର ଭୌତିକ ଧର୍ମଗୁଡ଼ିକ ଭିନ୍ନ ଅଟେ ।
(iii) ଯେଉଁ ମୌଳିକର ଆଇସୋଟୋପ୍ ନାହିଁ, ସେହି ମୌଳିକର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ, ଏହାର ପରମାଣୁରେ ଥିବା ପ୍ରୋଟନ୍ ସଂଖ୍ୟା ଓ ନିଉଟ୍ରନ୍ ସଂଖ୍ଯାର ସମଷ୍ଟି ସହିତ ସମାନ ।
ଉଦାହରଣ :
(a) ହାଇଡ୍ରୋଜେନ୍ର 3ଟି ଆଇସୋଟୋପ୍ ହେଲା- ହାଇଡ୍ରୋଜେନ୍ ବା ପ୍ରୋଟିୟମ୍ (11H), ଡିଉଟେରିୟମ୍ (21H ବା D) ଏବଂ ଟ୍ରାଇଟିୟମ୍ (31H ବା T) ।
(b) ନାଇଟ୍ରୋଜେନ୍ ର 2ଟି ଆଇସୋଟୋପ୍ ହେଲା – 147N ଏବଂ 157N ।
(c) ଅକ୍ସିଜେନ୍ ର 3ଟି ଆଇସୋଟୋପ୍ ହେଲା – 168O, 178O ଏବଂ 188O ।
(d) କ୍ଲୋରିନ୍ ର 2ଟି ଆଇସୋଟୋପ୍ ହେଲା – 3517Cl ଏବଂ 3717Cl ।
(e) ପୋଟାସିୟମ୍ର 3ଟି ଆଇସୋଟୋପ୍ ହେଲା – 3919K, 4019K ଏବଂ 4119K
![]()
ଆଇସୋଟୋପ୍ର ବସ୍ତୁତ୍ଵ ନିରୂପଣ :
(i) ଯେଉଁ ମୌଳିକର ଆଇସୋଟୋପ୍ ରହିଛି, ତାହାର ବସ୍ତୁତ୍ଵ ନିରୂପଣ କରିବାପାଇଁ ଆଇସୋଟୋପ୍ଗୁଡ଼ିକର ଶତକଡ଼ା ଅନୁପାତ ଜାଣିବା ଆବଶ୍ୟକ ।
(ii) 3517Cl ଏବଂ 3717Cl ପ୍ରକୃତିରେ ଯଥାକ୍ରମେ 75% ଓ 25% ଅନୁପାତରେ ମିଳେ ।
(iii) କ୍ଲୋରିନ୍ ପରମାଣୁର ହାରାହାରି ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ
= 35 × \(\frac{75}{00}+37 \times \frac{25}{100}=\frac{105}{4}+\frac{37}{4}=\frac{142}{4}\) = 35.5u
(iv) ଏକ ନିର୍ଦ୍ଦିଷ୍ଟ ପରିମାଣର କ୍ଲୋରିନ୍ରେ ଦୁଇଟିଯାକ ଆଇସୋଟୋପ୍ ରହିଥାଏ ଏବଂ କ୍ଲୋରିନ୍ ହାରାହାରି ବସ୍ତୁତ୍ଵ ହେଉଛି 35.5u ।
→ ଆଇସୋବାର୍ (Isobar):
ସମାନ ବସ୍ତୁତ୍ଵ ସଂଖ୍ୟା କିନ୍ତୁ ଭିନ୍ନ ପରମାଣୁ କ୍ରମାଙ୍କର ପରମାଣୁଗୁଡ଼ିକୁ ଆଇସୋବାର୍ କୁହାଯାଏ ।
ଉଦାହରଣ :
4019K ଓ 4020Ca ଆଇସୋବାର୍ ଅଟନ୍ତି ।
