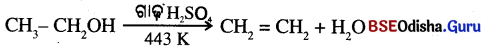Odisha State Board BSE Odisha 10th Class Physical Science Notes Chapter 4 କାର୍ବନ ଓ ଏହାର ଯୌଗିକ will enable students to study smartly.
BSE Odisha Class 10 Physical Science Notes Chapter 4 କାର୍ବନ ଓ ଏହାର ଯୌଗିକ
→ ଉପକ୍ରମ (Introduction) :
- ଅଧୂକ । ଖାଦ୍ୟ, ବସ୍ତ୍ର, ବିଭିନ୍ନ ଔଷଧ, ଆସବାବପତ୍ର, କୋଇଲା, ପେଟ୍ରୋଲିୟମ୍, ପଲିମର ଇତ୍ୟାଦିରେ କାର୍ବନ ଅନ୍ୟ ମୌଳିକ ସହିତ ମିଶି ରହିଥାଏ ।
- ସମସ୍ତ ଜୀବନ୍ତ ପଦାର୍ଥରେ କାର୍ବନ ଏକ ମୁଖ୍ୟ ଉପାଦାନ ।
- କାର୍ବନ ଏକ ଅଧାତୁ ମୌଳିକ ଓ ଏହାର ପ୍ରତୀକ C ।
- ପର୍ଯ୍ୟାୟ ସାରଣୀର ଦ୍ୱିତୀୟ ପର୍ଯ୍ୟାୟ ଓ ଗ୍ରୁପ୍ 14 ରେ କାର୍ବନ ଅବସ୍ଥିତ ।
- କାର୍ବନ ଚତୁଃ ସଂଯୋଜୀ ।
- ଭୂପୃଷ୍ଠରେ ଏବଂ ବାୟୁମଣ୍ଡଳରେ କାର୍ବନର ପରିମାଣ ଅତି ଅଳ୍ପ ।
- ଖଣିଜ ରୂପରେ (କାର୍ବୋନେଟ୍, ହାଇଡ୍ରୋଜେନ କାର୍ବୋନେଟ୍, କୋଇଲା ଏବଂ ପେଟ୍ରୋଲିମରୂପେ) ଭୂପୃଷ୍ଠରେ କାର୍ବନର ପରିମାଣ ହେଉଛି ମାତ୍ର 0.02% ଏବଂ ବାୟୁମଣ୍ଡଳରେ କାର୍ବନ ଡାଇଅକ୍ସାଇଡ଼ର ପରିମାଣ 0.03% |
→ କାର୍ବନରେ ବନ୍ଧ – ସହସଂଯୋଗ୍ୟ ବନ୍ଧ (Bonding in Carbon – The Covalent Bond) :
ବିଦ୍ୟୁତ୍ ସଂଯୋଜ୍ୟ ବନ୍ଧ (Electrovalent Bond) :
- ବିଦ୍ୟୁତ୍ ସଂଯୋଜ୍ୟ ଯୌଗିକ ବା ଆୟନିକ ଯୌଗିକ ଗଠନ ସମୟରେ ଗୋଟିଏ ପରମାଣୁରୁ ଅନ୍ୟ ଏକ ପରମାଣୁକୁ ଏକ ବା ଏକାଧ୍ଵ ଇଲେକ୍ଟ୍ରନ୍ର ସ୍ଥାନାନ୍ତରଣ ଫଳରେ ବନ୍ଧ ସୃଷ୍ଟି ହୋଇଥାଏ ।
- ଏ ପ୍ରକାର ସ୍ଥାନାନ୍ତରଣରେ ଗୋଟିଏ ପରମାଣୁ ଇଲେକ୍ଟ୍ରନ୍ ତ୍ୟାଗ କରି ଏବଂ ଅନ୍ୟ ପରମାଣୁ ଇଲେକ୍ଟ୍ରନ୍ ଗ୍ରହଣ କରି ନିଜର ଅଷ୍ଟକ ସୂତ୍ର ସଂପୂର୍ଣ୍ଣ କରିଥାନ୍ତି ।
- ଫଳରେ ଯୁକ୍ତ ଚାର୍ଜିତ କାଟାୟନ ଓ ବିଯୁକ୍ତ ଏନାୟନ ସୃଷ୍ଟି ହୋଇ ଦୃଢ଼ ବୈଦ୍ୟୁତିକ ଆକର୍ଷଣ ଦ୍ବାରା ସନ୍ଧି ଉପରେ ବିଦ୍ୟୁତ୍ ସଂଯୋଗ୍ୟ ବନ୍ଧ ବା ଆୟନିକ୍ ବନ୍ଧ ଗଠନ କରନ୍ତି ।
- ଏହି ବନ୍ଧଦ୍ବାରା ଉତ୍ପନ୍ନ ଯୌଗିକକୁ ବିଦ୍ୟୁତ୍ ସଂଯୋଜ୍ୟ ଯୌଗିକ ବା ଆୟନିକ୍ ଯୌଗିକ କହନ୍ତି ।
- ଆୟନିକ ଯୌଗିକଗୁଡ଼ିକର ଗଳନାଙ୍କ ଓ ସ୍ଫୁଟନାଙ୍କ ଅତି ଉଚ୍ଚ ହୋଇଥାଏ ।
- ଏଗୁଡ଼ିକ ଦ୍ରବଣରେ କିମ୍ବା ତରଳ ଅବସ୍ଥାରେ ବିଦ୍ୟୁତ୍ ପରିବହନ କରନ୍ତି ।
- ବିଦ୍ୟୁତ ସଂଯୋଗ୍ୟ ଯୌଗିକଗୁଡ଼ିକ ସାଧାରଣତଃ ଜଳରେ ଦ୍ରବଣୀୟ ଏବଂ କିରୋସିନି, ପେଟ୍ରୋଲ ଆଦି ଦ୍ରାବକରେ ଅଦ୍ରବଣୀୟ ଅଟନ୍ତି ।
କାର୍ବନର କେତୋଟି ଯୌଗିକର ଗଳନାଙ୍କ ଓ ସ୍ଫୁଟନାଙ୍କ
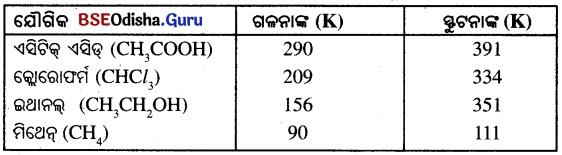
- (iv) ସାରଣୀରେ ଦିଆଯାଇଥିବା କାର୍ବନ ଯୌଗିକଗୁଡ଼ିକର ଗଳନାଙ୍କ ଓ ସ୍ଫୁଟନାଙ୍କ ବହୁତ୍ କମ୍ କାରଣ ଅଣୁଗୁଡ଼ିକ ମଧ୍ୟରେ ଆକର୍ଷଣ ବଳ ବେଶୀ ଦୃଢ଼ ନୁହେଁ ।
- (v) କାର୍ବନ ଯୌଗିକଗୁଡ଼ିକ ବିଶେଷଭାବରେ ବିଦ୍ୟୁତ୍ କୁପରିବାହୀ । କାରଣ ଏହି ଯୌଗିକଗୁଡ଼ିକର ବନ୍ଧ କୌଣସି ଆୟନ ସୃଷ୍ଟିକରେ ନାହିଁ ।
![]()
→ କାର୍ବନ ସର୍ବଦା ସହସଂଯୋଜ୍ୟ ବନ୍ଧ ଗଠନ କରେ :
- କାର୍ବନର ପରମାଣୁ କ୍ରମାଙ୍କ 6 ଓ ଇଲେକ୍ଟ୍ରନ ସଂରଚନା K(2) ଓ L(4) ।
- ମୌଳିକଗୁଡ଼ିକର ପ୍ରତିକ୍ରିୟାଣାଲଗା ବୁଝାଇବାକ୍ତ ପେଗୁଡ଼ିକର ବାହ୍ୟତମ କକ୍ଷରେ ସମ୍ପୂର୍ଣ୍ଣ ମାତ୍ରାରେ ଇଲେକ୍ଟ୍ରନ ରହିବାପାଇଁ ଚେଷ୍ଟା ଅର୍ଥାତ୍ ନିକଟତମ ନିଷ୍କ୍ରିୟଗ୍ୟାସର ସଂରଚନା ଲାଭ କରିବାର ପ୍ରୟାସ କରେ ।
- ନିଷ୍କ୍ରିୟ ଗ୍ୟାସ୍ ହିଲିୟମ୍ର K କକ୍ଷରେ 2ଟି ଇଲେକ୍ଟ୍ରନ ଓ ଅନ୍ୟ ଇଲେକଟ୍ରନ୍ ଅଛି । ନିଷ୍କ୍ରିୟ ଗ୍ୟାସ୍ର ବହିଃସ୍ଥ କକ୍ଷରେ 8ଟି
- ବାହ୍ୟତମ ଇଲେକ୍ଟ୍ରନ ଗ୍ରହଣ ବା ତ୍ୟାଗକରି ମୌଳିକ ଗୁଡ଼ିକ ଆୟନିକ ଯୌଗିକ ସୃଷ୍ଟିକରେ ।
- କାର୍ବନର ବହିଃସ୍ଥ କକ୍ଷରେ 4ଟି ଇଲେକ୍ଟ୍ରନ ଅଛି । ନିଷ୍କ୍ରିୟ ଗ୍ୟାସ୍ର ଇଲେକ୍ଟ୍ରନ ସଂରଚନା ଧାରଣ କରିବାପାଇଁ ଚାରୋଟି ଇଲେକ୍ଟ୍ରନ ଗ୍ରହଣ କରିବା କିମ୍ବା ତ୍ୟାଗକରିବା ଆବଶ୍ୟକ । ପ୍ରୋଟନ ଥିବା ନ୍ୟୁକ୍ଲିୟସ କଷ୍ଟକର ।
- ଯଦି କାର୍ବନ ଏତେ ସଂଖ୍ୟକ ଇଲେକ୍ଟ୍ରନ୍ ଗ୍ରହଣ କିମ୍ବା ତ୍ୟାଗ କରନ୍ତା ତେବେ ନିମ୍ନଲିଖ୍ ସମସ୍ୟା ହୁଅନ୍ତା ।
- C ଏନାୟନ ସୃଷ୍ଟି କରିବାପାଇଁ 4ଟି ଇଲେକ୍ଟ୍ରନ ଆବଶ୍ୟକ । କିନ୍ତୁ ଟି ପାଇଁ 10ଟି ଇଲେକ୍ଟ୍ରନ ଅର୍ଥାତ୍ 4ଟି ଅଧିକ ଇଲେକ୍ଟ୍ରନ୍ ଆୟତ୍ତରେ ରଖ୍
- C+ କାଟାୟନ ସୃଷ୍ଟିକରିବାକୁ ହେଲେ 4ଟି ଇଲେକ୍ଟ୍ରନ ତ୍ୟାଗକରିବା ଆବଶ୍ୟକ କାର୍ବନ ନ୍ୟୁକ୍ଲିୟସରୁ 4ଟି ଇଲେକ୍ଟ୍ରନକୁ ଅପସାରଣ କରିବାପାଇଁ ବହୁତ ଅଧିକ ଶକ୍ତି ଦରକାର ହେବ କାରଣ କାର୍ବନ କାଟାୟନ ଗଠନ ହେବାପାଇଁ କେବଳ 2ଟି ଇଲେକ୍ଟ୍ରନକୁ ଧରି ରଖୁବ । ଏହାର ନ୍ୟୁକ୍ଲିୟସରେ ଟି ପ୍ରୋଟନ ଥିବାରୁ ତାଠାରୁ 4ଟି ଇଲେକ୍ଟ୍ରନ ଦୂରେଇ ନେବା ପାଇଁ ଅଧିକ ଶକ୍ତି ଦରକାର ।
- ତେଣୁ କାର୍ବନ ଏହାର ସଂଯୋଜକ ଇଲେକ୍ଟ୍ରନଗୁଡ଼ିକ ଅନ୍ୟ କାର୍ବନର ପରମାଣୁ ସହ କିମ୍ବା ଅନ୍ୟ ମୌଳିକର ପରମାଣୁ ସହ ସହଭାଜନ (sharing) ଦ୍ଵାରା ଅଣୁ ସୃଷ୍ଟି କରେ ଏବଂ ଉଭୟଙ୍କର ପରମାଣୁକୁ ନିଷ୍କ୍ରିୟ ଗ୍ୟାସ୍ ସଂରଚନା ପ୍ରଦାନ କରେ । ଦୁଇ ପରମାଣୁ ମଧ୍ଯରେ ଇଲେକ୍ଟ୍ରନ ସହଭାଜନ ଦ୍ୱାରା ଗଠିତ ବନ୍ଧକୁ ସହ ସଂଯୋଜ୍ୟ ବନ୍ଧ କୁହାଯାଏ ।
→ ସହସଂଯୋଜ୍ୟ ବନ୍ଧର ପ୍ରକାରଭେଦ :
ସହ ସଂଯୋଗ୍ୟ ବନ୍ଧ ତିନି ପ୍ରକାରର ।
- ଏକ ବନ୍ଧ: ପ୍ରତ୍ୟେକ ପରମାଣୁ ଗୋଟିଏ ଲେଖାଏଁ ଇଲେକ୍ଟ୍ରନ ସହ ପରସ୍ପର ଭାଗକରିଥାନ୍ତି, ଫଳରେ ଗୋଟିଏ ବନ୍ଧ ଗଠିତ ହୁଏ । ଉଦାହରଣ : ହାଇଡ୍ରୋଜେନ ଅଣୁ (H2) ।
- ଦ୍ଵିବନ୍ଧ: ପ୍ରତ୍ୟେକ ପରମାଣୁ ଦୁଇଟି ଲେଖାଏଁ ଇଲେକ୍ଟ୍ରନ୍ ଭାଗକରି ଦୁଇଟି ବନ୍ଧ ଗଠନ କରନ୍ତି । ଉଦାହରଣ : ଅକ୍ସିଜେନ ଅଣୁ (O2 ) ।
- ତ୍ରିବନ୍ଧ : ପ୍ରତ୍ୟେକ ପରମାଣୁ ତିନୋଟି ଲେଖାଏଁ ଇଲେକଟ୍ରନ୍ ଭାଗ କରିବାଦ୍ଵାରା ତ୍ରି-ବନ୍ଧ ଗଠିତ ହୁଏ । (N2) ।
→ (a) ଏକ ବନ୍ଧଥିବା ଅଣୁ :
ହାଇଡ୍ରୋଜେନ୍ ଅଣୁ :
- ହାଇଡ୍ରୋଜେନର ପରମାଣୁ କ୍ରମାଙ୍କ 1 ।
- ଏହାର K – କକ୍ଷରେ ଗୋଟିଏ ଇଲେକ୍ ଟ୍ରନ ରହିଛି ।
- K-କକ୍ଷ ପୂର୍ଣ୍ଣ ହେବାପାଇଁ ଆଉ ଗୋଟିଏ ଇଲେକ୍ଟ୍ରନ ଦରକାର ।
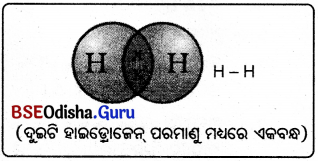
- ଗୋଟିଏ ହାଇଡ୍ରୋଜେନ ଅଣୁ ସୃଷ୍ଟିପାଇଁ ଦୁଇଟି ହାଇଡ୍ରୋଜେନ ପରମାଣୁ ସେମାନଙ୍କର ଇଲେକ୍ଟ୍ରନ ଗୁଡ଼ିକୁ ପରସ୍ପର ମଧ୍ୟରେ ଭାଗ କରନ୍ତି ।
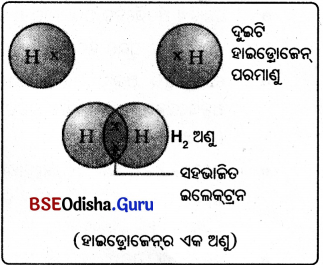
- ଫଳରେ ପ୍ରତ୍ୟେକ ହାଇଡ୍ରୋଜେନ ପରମାଣୁ ଏହାଦ୍ୱାରା ନିକଟତମ ନିଷ୍କ୍ରିୟ ଗ୍ୟାସ୍ ପରମାଣୁ ହିଲିୟମ୍ର ଇଲେକ୍ଟ୍ରନ ସଂରଚନା ଧାରଣ କରେ ।
- ସଂଯୋଜକ ଇଲେକ୍ଟ୍ରନ୍ ପାଇଁ ଡଟ୍ ( · ) କିମ୍ବା ଛକି (x) ବ୍ୟବହାର କରାଯାଇଛି ।
- ସହଭାଜିତ ଇଲେକ୍ଟ୍ରନ ଯୁଗଳ (shared pair of electrons) ଦୁଇଟି ହାଇଡ୍ରୋଜେନ ପରମାଣୁ ମଧ୍ୟରେ ଏକ ବନ୍ଧ ଗଠନ କରିଛି ବୋଲି କୁହାଯାଏ।
- ଗୋଟିଏ ଏକ ବନ୍ଧକୁ ଦୁଇଟି ପରମାଣୁ ମଧ୍ୟରେ ଏକ ରେଖାଖଣ୍ଡ (– ) ଦ୍ବାରା ଦର୍ଶାଯାଇଛି ।
→ କ୍ଲୋରିନ୍ ଅଣୁ:
- କ୍ଲୋରିନ୍ର ପରମାଣୁ କ୍ରମାଙ୍କ 17 ଅଟେ ।
- ଏହାର ଇଲେକ୍ଟ୍ରନ ସଂରଚନା 2, 8, 7 1
- ପ୍ରତି କ୍ଲୋରିନ୍ ପରମାଣୁର ବାହ୍ୟତମ କକ୍ଷରେ 7ଟି ଇଲେକ୍ଟ୍ରନ୍ ଥିବାରୁ ଯେତେବେଳେ ଦୁଇଟି କ୍ଲୋରିନ୍ ପରମାଣୁ ପରସ୍ପର ନିକଟତର ହୁଅନ୍ତି ।
- ଉଭୟଙ୍କର ଗୋଟିଏ ଲେଖାଏଁ ଇଲେକ୍ଟ୍ରନ୍ ସେମାନଙ୍କ ମଧ୍ୟରେ ସହଭାଜିତ ହୁଅନ୍ତି ।
- ସହଭାଜିତ ଇଲେକ୍ଟ୍ରନ୍ ଯୁଗଳରେ ଉଭୟ କ୍ଲୋରିନ୍ ପରମାଣୁ ନ୍ୟୁକ୍ଲିୟସ୍ ସମ୍ମିଳିତ ପ୍ରଭାବରେ ରହିଥାଏ ।
- ଏହି ସମ୍ମିଳିତ ପ୍ରଭାବରୁ ଉତ୍ପନ୍ନ ଆକର୍ଷଣ ବଳଦ୍ୱାରା ପ୍ରତ୍ୟେକ କ୍ଲୋରିନ୍ ପରମାଣୁ ସହଭାଜନ ଫଳରେ ନିକଟତମ ନିଷ୍କ୍ରିୟ ଗ୍ୟାସ୍ରର ସଂରଚନା ପ୍ରାପ୍ତ ହୁଏ।
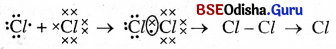
→ (b) ଦ୍ଵିବନ୍ଧ ଥିବା ଅଣୁ:
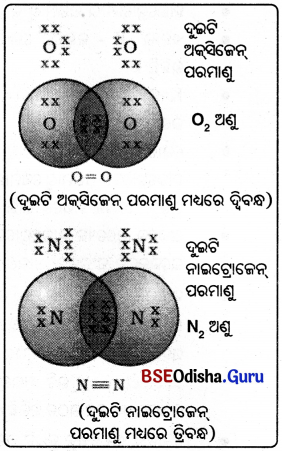
- ଅକସିଜେନ୍ର ପରମାଣୁ କ୍ରମାଙ୍କ 8 ଓ ଏହାର ଇଲେକ୍ଟ୍ରନ୍ ସଂରଚନା 2, 6 1
- ଗୋଟିଏ ଅକ୍ସିଜେନ ପରମାଣୁର L କକ୍ଷରେ ଚୈ ଇଲେକ୍ଟ୍ରନ ଅଛି ।
- ଏହା ଅକ୍ଳେଟ୍ ପୂରଣ କରିବାପାଇଁ ଆଉ 2ଟି ଇଲେକ୍ଟ୍ରନ୍ ଆବଶ୍ୟକ କରେ ।
- ତେଣୁ ପ୍ରତି ଅକ୍ସିଜେନ୍ ର ପରମାଣୁ ଅନ୍ୟ ଏକ ଅକ୍ସିଜେନର ପରମାଣୁସହିତ ଦୁଇଟି ଇଲେକ୍ଟ୍ରନ ଭାଗ (share) କରିଥାଏ ।
- ପ୍ରତ୍ୟେକ ଅକ୍ସିଜେନ ପରମାଣୁଦ୍ଵାରା ମିଳୁଥିବା ଇଲେକ୍ ଟ୍ରନ ଦୁଇଟି ସହଭାଜିତ ଇଲେକ୍ ଟ୍ରନ ଯୁଗଳ ହେଇଥାଏ
- ଏହାକୁ ଦୁଇଟି ପରମାଣୁ ମଧ୍ୟରେ ଦ୍ବିବନ୍ଧ ଗଠନହେଲା ବୋଲି କୁହାଯାଏ
→ (c) ତ୍ରିବନ୍ଧ ଥିବା ବନ୍ଧ :
ନାଇଟ୍ରୋଜେନ୍ :
- ନାଇଟ୍ରୋଜେନର ପରମାଣୁ କ୍ରମାଙ୍କ 7 ଓ ଏହାର ଇଲେକ୍ଟ୍ରନ୍ ସଂରଚନା 2, 5 1
- ଅକ୍ଟୋଟ୍ ଲାଭ କରିବା ପାଇଁ ଗୋଟିଏ ନାଇଟ୍ରୋଜେନ ପରମାଣୁ ତିନୋଟି ଇଲେକ୍ଟ୍ରନ ଦେଇଥାଏ ।
- ସହଭାଗୀ ଇଲେକ୍ଟ୍ରନ ଯୁଗଳ ପାଇଁ ପ୍ରତି ନାଇଟ୍ରୋଜେନ ଅଣୁରେ ତିନୋଟି ସହଭାଗୀ ଇଲେକ୍ଟ୍ରନ ଯୁଗଳପାଇଁ ପ୍ରତି ନାଇଟ୍ରୋଜେନ୍ ପରମାଣୁ ତିନୋଟି ଇଲେକଟ୍ରନ ଦେଇଥାଏ ।
- ଏହାକୁ ଦୁଇଟି ପରମାଣୁ ମଧ୍ଯରେ ତ୍ରିବନ୍ଧ ଗଠନ ହେଲା ବୋଲି କୁହାଯାଏ ।
![]()
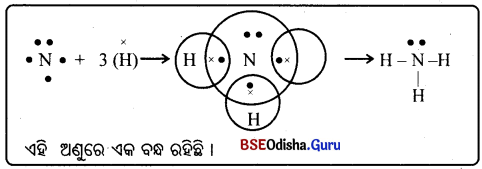
→ ଏମୋନିଆ ଅଣୁବ ଗଠନ :
- ନାଇଟ୍ରୋଜେନ୍ର ପରମାଣୁ କ୍ରମାଙ୍କ 7 ଓ ଏହାର ଇଲେକ୍ଟ୍ରନ ସଂରଚନା 2, 5 |
- ନାଇଟ୍ରୋଜେନର ବହିଃସ୍ଥ କକ୍ଷରେ 5 ଟି ଇଲେକ୍ଟ୍ରନ ଅଛି । ଏହା ଅକ୍ଳେଟ୍ ପୂରଣ ପାଇଁ ଆହୁରି 3ଟି ଇଲେକ୍ଟ୍ରନ୍ ଆବଶ୍ୟକ କରୁଛି । ଯାହାଫଳରେ ନିକଟତମ ନିଷ୍କ୍ରିୟ ଗ୍ୟାସ୍ Neର ସଂରଚନା ଧାରଣ କରିପାରିବ ।
- ହାଇଡ୍ରୋଜେନର ପରମାଣୁ କ୍ରମାଙ୍କ 1 ଓ ଏହାର ଇଲେକ୍ଟ୍ରନ ସଂରଚନା K(1) । ଆଉ ଗୋଟିଏ ଇଲେକ୍ଟ୍ରନ ହେଲେ ତାହା ନିକଟତମ ନିଷ୍କ୍ରିୟ ଗ୍ୟାସ୍ He ର ସଂରଚନା ଧାରଣ କରିବ ।
- ଅକ୍ଳେଟ୍ ପୂରଣ ପାଇଁ ନାଇଟ୍ରୋଜେନ୍ ତାହାର ବହିଃସ୍ଥ କକ୍ଷରେ 3ଟି ଇଲେକ୍ଟ୍ରନ ସହିତ ହାଇଡ୍ରୋଜେନ୍ ତିନୋଟିର ପ୍ରତ୍ୟେକ ଇଲେକ୍ଟ୍ରନ ସହଭାଗିତାରେ N – H ଏକ ବନ୍ଧ ଗଠନ କରନ୍ତି ।
- ନୀଇଟ୍ରୋଜେନ୍ର ଅନ୍ୟ ଦୁଇଟି ଇଲେକ୍ଟ୍ରନ କୌଣସି ବନ୍ଧ ଗଠନରେ ଭାଗ ନ ନେଇ ସେହିପରି ରହିଥାଏ ।
→ ମିଥେନ୍ ଅସୁର ଗଠନ :
- ମିଥେନ କାର୍ବନର ଏକ ଯୌଗିକ ଓ ଏହାର ସଂକେତ CH4 ।
- ଏହା ଇନ୍ଧନରୂପେ ବହୁଳ ଭାବରେ ବ୍ୟବହୃତ ହୁଏ । ଏହା ଏକ ଜୈବ ଗ୍ୟାସ (Biogas) ଓ ସଂଚାପିତ ପ୍ରାକୃତିକ ଗ୍ୟାସ୍ (Compressed Natural Gas ବା CNG)ର ମୁଖ୍ୟ ଉପାଦାନ ।
- କାର୍ବନର ପରମାଣୁ କ୍ରମାଙ୍କ 6 ଓ ଏହାର ଇଲେକ୍ଟ୍ରନ ସଂରଚନା K(2), L(4) ।
- ହାଇଡ୍ରୋଜେନର ପରମାଣୁ କ୍ରମାଙ୍କ । ଏବଂ ଇଲେକ୍ଟ୍ରନ୍ ସଂରଚନା K(1) । ଏହା ନିକଟତମ ନିଷ୍କ୍ରିୟ ଗ୍ୟାସ୍ର ସଂରଚନା ଲାଭ କରିବାପାଇଁ ଆଉ ଗୋଟିଏ ଇଲେକ୍ଟ୍ରନ୍ ଆବଶ୍ୟକ କରିଥାଏ ।
- କାର୍ବନର ଚାରୋଟି ସଂଯୋଜକ ଇଲେକ୍ଟ୍ରନ ରହିଛି । ନିକଟତମ ନିଷ୍କ୍ରିୟ ଗ୍ୟାସ୍ ସଂରଚନା ଲାଭ କରିବା ପାଇଁ କାର୍ବନ ଏହି ଇଲେକ୍ଟ୍ରନ ଗୁଡ଼ିକୁ 4ଟି ହାଇଡ୍ରୋଜେନ ପରମାଣୁ ସହିତ ଭାଗ କରିଥାଏ ।
- ଅକ୍ଟୋଟ୍ ପୂରଣ କରିବା ପାଇଁ କାର୍ବନ ଏହି ଇଲେକ୍ଟ୍ରନ ଗୁଡ଼ିକୁ ଚାରୋଟି ହାଇଡ୍ରୋଜେନ ପରମାଣୁ ସହିତ ଭାଗ କରିଥାଏ ଫଳରେ C – Hର ଏକ ସହସଂଯୋଜ୍ୟ ବନ୍ଧ ଗଠିତ ହୁଏ ।
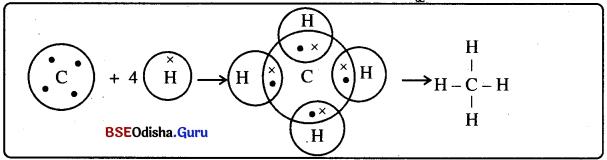
- C – H ବନ୍ଧ ଏକ ସମତଳରେ ରହନ୍ତି ନାହିଁ । ଏହା ଟେଟ୍ରାହେନ୍ଦ୍ରର ଚାରିକୋଣ ଆଡ଼କୁ ମୁହାଁଇଥାନ୍ତି । ସହସଂଯୋଜ୍ୟ ଅଣୁଗୁଡ଼ିକର ଗୁଣ:
→ ସତଫପୋଇ ଅଣୁଗୁଡ଼ିକର ଖୁଣ :
- ସହ ସଂଯୋଗ୍ୟ ବନ୍ଧଦ୍ବାରା ଗଠିତ ଅଣୁଗୁଡ଼ିକର ଅଣୁର ଅଭ୍ୟନ୍ତରରେ ଶକ୍ତ ବନ୍ଧ ରହିଥିବା ଦେଖାଯାଏ, କିନ୍ତୁ ଆନ୍ତଃଅଣୁକ (Intermolecular) ବଳ କମ୍ ଥାଏ ।
- ସହସଂଯୋଜ୍ୟ ଯୌଗିକଗୁଡ଼କର ଗଳନାଙ୍କ ଓ ସ୍ଫୁଟନାଙ୍କ କମ୍ ହୋଇଥାଏ ।
- ଏହି ଯୌଗିକଗୁଡ଼ିକ ସାଧାରଣତଃ ବିଦ୍ୟୁତ୍ କୁପରିବାହୀ । କାରଣ ଯୌଗିକଗୁଡ଼ିକର ଦୁଇ ପରମାଣୁ ମଧ୍ୟରେ ମିଳିତ ଭାବେ ଇଲେକ୍ଟ୍ରନ ଭାଗ ହୋଇଥାଏ ଏବଂ ଚାର୍ଜଯୁକ୍ତ କଣିକାମାନ ସୃଷ୍ଟି ହୋଇନଥାଏ ।
![]()
→ ଜାଇଁ ନବ ବିଭିନ୍ ରୂପ (Allotropes of Carbon):
- ପ୍ରକୃତିରେ କାର୍ବନ ମୌଳିକ ବିଭିନ୍ନ ରୂପରେ ମିଳିଥାଏ । ବିଭିନ୍ନ ରୂପଗୁଡ଼ିକର ରାସାୟନିକ ପ୍ରକୃତି ସମାନ , ହେଲେ ମଧ୍ୟ ଭୌତିକ ପ୍ରକୃତି ପୃଥକ୍ ଅଟେ ।
- ଉଭୟ ହୀରା ଓ ଗ୍ରାଫାଇଟ୍ କାର୍ବନ ପରମାଣୁ ଦ୍ଵାରା ଗଠିତ ହୋଇଥାଏ, କିନ୍ତୁ ଏ ଦୁଇଟିରେ କାର୍ବନ-କାର୍ବନ
- ହୀରାରେ ପ୍ରତ୍ୟେକ କାର୍ବନ ପରମାଣୁ ଅନ୍ୟ ଚାରୋଟି କାର୍ବନ ପରମାଣୁ ସହିତ ସଂଯୁକ୍ତ ହୋଇଥାଏ ଏବଂ ଏକ ଦୃଢ଼ ତ୍ରିବିମୀୟ (three-dimensional) ସଂରଚନା ଗଠନ କରେ ।
- ଗ୍ରାଫାଇଟ୍ରେ ପ୍ରତ୍ୟେକ କାର୍ବନ ପରମାଣୁ ଅନ୍ୟ ତିନୋଟି କାର୍ବନ ପରମାଣୁ ସହିତ ଏକ ସମତଳରେ ବନ୍ଧ ଗଠନ କରିଥାଏ ଏବଂ ଏକ ଷଡ଼ଭୁଜୀୟ ବିନ୍ୟାସ (Hexagonal array) ଦେଇଥାଏ । ଏହି ବନ୍ଧଗୁଡ଼ିକ ମଧ୍ୟରୁ ଗୋଟିଏ ହେଉଛି ଦ୍ଵିବନ୍ଧ । ତେଣୁ କାର୍ବନର ଯୋଗ୍ୟତା ସନ୍ତୁଷ୍ଟ ହୋଇଥାଏ ।
- ଷଡ଼ଭୁଜୀୟ ବିନ୍ୟାସଗୁଡ଼ିକ ଗୋଟିଏ ସ୍ତର ଉପରେ ଆଉ ଏକ ସ୍ତର ଏହିପରି ଅନେକ ସ୍ତର ରହିବାଦ୍ଵାରା ଗ୍ରାଫାଇଟ୍ ସଂରଚନା ସୃଷ୍ଟି ହୋଇଥାଏ ।
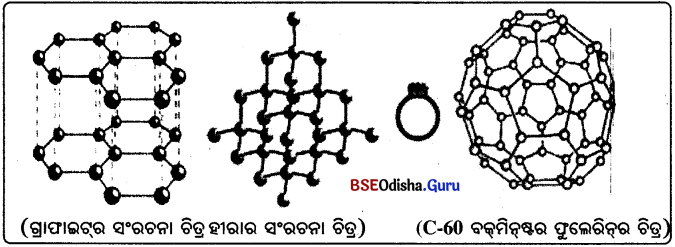
- ଏହି ଦୁଇ ଭିନ୍ନ ଭିନ୍ନ ସଂରଚନା ଫଳରେ ହୀରା ଓ ଗ୍ରାଫାଇଟ୍ର ଭୌତିକ ଧର୍ମ ଭିନ୍ନ ହୋଇଥାଏ ଯଦିଓ ସେ ଦୁଇଟିର ରାସାୟନିକ ଧର୍ମ ସମାନ ।
- ପଦାର୍ଥଗୁଡ଼ିକ ମଧ୍ୟରେ ହୀରା ସବୁଠାରୁ ବେଶି ଶକ୍ତ । ଗ୍ରାଫାଇଟ୍ ହେଉଛି କୋମଳ (Smooth) ଏବଂ ହାତରେ ଧରିଲେ ଚିକ୍କଣ ବା ତେଲିଆ ଜଣାପଡ଼େ।
- ଗ୍ରାଫାଇଟ୍ ଅଧାତୁ ହେଲେ ମଧ୍ୟ ବିଦ୍ୟୁତ୍ ପରିବହନ କରେ ।
- ଅତି ଉଚ୍ଚ ଚାପ ଓ ତାପମାତ୍ରା ପ୍ରୟୋଗ କରି ବିଶୁଦ୍ଧ କାର୍ବନରୁ ହୀରା ସଂଶ୍ଳେଷଣ କରାଯାଇପାରିବ । ଏହି ସଂଶ୍ଲେଷିତ ହୀରାଗୁଡ଼ିକ ଛୋଟ, ଅନ୍ୟଥା ପ୍ରାକୃତିକ ହୀରାଠାରୁ କୌଣସି ଗୁଣରେ ଭିନ୍ନ ନୁହେଁ ।
- କାର୍ବନର ଆଉ ଏକ ରୂପ ହେଉଛି ଫୁଲେରିନ୍ । ପ୍ରଥମେ ଚିହ୍ନିତ ହୋଇଥିବା କାର୍ବନର ଏହି ରୂପଟି ହେଲା, C-60, ଯେଉଁଥରେ କାର୍ବନ ପରମାଣୁଗୁଡ଼ିକ ଫୁଟ୍ବଲ ଆକାରରେ ସଜ୍ଜିତ ହୋଇ ରହିଥାଏ । ଏହା ଯୁକ୍ତରାଷ୍ଟ୍ର ଆମେରିକାର ସ୍ଥପତି ବକ୍ମିନ୍ଷ୍ଟର ଫୁଲର୍ (Buckminster Fuller)ଙ୍କ ଦ୍ବାରା ପରିକଳ୍ପନା କରାଯାଇଥିବା ଭୂପରିମାଣ ବିଦ୍ୟା ସମ୍ବନ୍ଧୀୟ ଗମ୍ବୁଜ (Geodesic dome) ପରି ଦେଖାଯାଉଥିବାରୁ ଏହି ଅଣୁକୁ ଫୁଲେରିନ୍ ନାମ ଦିଆଯାଇଥିଲା ।
→ କାର୍ବନର ସଂବଂ ଗୁଣଧାର1 ପ୍ରକୃତି (Versatile Nature of Carbon) :
- ଆମେ ବ୍ୟବହାର କରୁଥିବା ଅନେକ ଜିନିଷରେ କାର୍ବନ ଅଛି ।
- ଆମେ ନିଜେ କାର୍ବନ ଯୌଗିକରେ ଗଠିତ ହୋଇଛୁ ।
- କାର୍ବନ ଯୌଗିକର ସଂଖ୍ୟା ହେଉଛି ତିନି ନିୟୁତ (million)ରୁ ଅଧ୍ଵ ।
- ସହ ସଂଯୋଗ୍ୟ ବନ୍ଧର ପ୍ରକୃତି କାର୍ବନକୁ ବହୁସଂଖ୍ୟାର ଯୌଗିକ ସୃଷ୍ଟି କରିବାକୁ ସମର୍ଥ ହୋଇଥାଏ ।
- କାର୍ବନ ବହୁ ସଂଖ୍ୟକ ଯୌଗିକ ସୃଷ୍ଟି କରିବାର କାରଣ ଗୁଡ଼ିକ ହେଲା
→ କାଟିନେସନ :
- କାର୍ବନ ଅନ୍ୟ କାର୍ବନ ପରମାଣୁ ସହିତ ବନ୍ଧ ଗଠନ କରି ବୃହତ୍ ଅଣୁ ସୃଷ୍ଟିକରିବା ପାଇଁ ଅନନ୍ୟ ସାମର୍ଥ୍ୟ ରହିଛି । ଏହି ଗୁଣକୁ କାଟିନେସ୍ କୁହାଯାଏ ।
- ଏହି ଯୌଗିକଗୁଡ଼ିକ କାର୍ବନର ଦୀର୍ଘ ଶୃଙ୍ଖଳ (Long chain), କାର୍ଟନର ଶାଖାଯୁକ୍ତ ଶୃଙ୍ଖଳ କିମ୍ବା କାର୍ବନ ପରମାଣୁଗୁଡ଼ିକର ଚକ୍ରୀୟ ସଜ୍ଜା ହୋଇପାରେ।
- କାର୍ବନ ପରମାଣୁ ଗୁଡ଼ିକ ଏକ-ବନ୍ଧ, ଦ୍ୱି-ବନ୍ଧ ବା ତ୍ରି-ବନ୍ଧ ଦ୍ଵାରା ସଂଯୁକ୍ତ ହୋଇପାରେ । ବନ୍ଧ ଗଠନକୁ ନେଇ କାର୍ବନ ଯୌଗିକକୁ ଦୁଇଭାଗରେ ବିଭକ୍ତ
- କରାଯାଏ; ଯଥା— ପୃକ୍ତ ଯୌଗିକ ଓ ଅପୃକ୍ତ ଯୌଗିକ । କାର୍ବନ ଯୌଗିକରେ ପ୍ରତ୍ୟେକ କାର୍ବନ ପରମାଣୁ କେବଳ ଏକ-ବନ୍ଧ ଦ୍ଵାରା ଅନ୍ୟ ପରମାଣୁ ସହିତ ସଂଯୁକ୍ତ ହେଲେ ତାହାକୁ ପୃକ୍ତ ଯୌଗିକ କୁହାଯାଏ ।
- ଯେଉଁ ଯୌଗିକଗୁଡ଼ିକରେ କାର୍ବନ-କାର୍ବନ ମଧ୍ୟରେ ଦ୍ବନ୍ଧ କିମ୍ବା ତ୍ରିବନ୍ଧ ଥାଏ, ସେଗୁଡ଼ିକୁ ଅପୃକ୍ତ ଯୌଗିକ କୁହାଯାଏ । ଉଭୟ କାର୍ବନ ଓ ସିଲିକନ୍ର ବହିଃସ୍ଥ କକ୍ଷରେ 4ଟି ଇଲେକ୍ଟ୍ରନ ଥାଏ । କିନ୍ତୁ କାର୍ବନର କାଟିନେସନ୍ ଗୁଣ ଅଧ୍ୟା ଦେଖାଯାଏ ।
- କାର୍ବନ ଶହ ଶହ ହାଇଡ୍ରୋଜେନ ସହିତ ସଂଯୁକ୍ତ ହୋଇ ଯୌଗିକ ସୃଷ୍ଟିକରେ । କିନ୍ତୁ ସିଲିକନ୍ ହାଇଡ୍ରୋଜେନ ସହ ମିଶି ଯେଉଁ ଯୌଗିକ ଗଠନ କରେ ତାହା କେବଳ ସାତ କିମ୍ବା ଆଠଟି ସିଲିକନ୍ ପରମାଣୁ ପର୍ଯ୍ୟନ୍ତ ଥାଏ, କିନ୍ତୁ ଏହି ଯୌଗିକଗୁଡ଼ିକ ଖୁବ୍ ପ୍ରତିକ୍ରିୟାଶୀଳ ।
- କାର୍ବନ-କାର୍ବନ ବନ୍ଧ ଖୁବ୍ ଶକ୍ତ, ତେଣୁ ତାହା ସ୍ଥାୟୀ ( stable)
![]()
→ (i) ଚତୁଃସଂଯୋଜୀ:
କାର୍ବନର ଯୋଗ୍ୟତା ଚାରି ହୋଇଥିବାରୁ ଏହା କାର୍ବନର ଅନ୍ୟ ଚାରୋଟି ପରମାଣୁ କିମ୍ବା ଏକ ଯୋଗ୍ୟତା ବିଶିଷ୍ଟ ଅନ୍ୟ ମୌଳିକର ପରମାଣୁ ସହ ବନ୍ଧ ଗଠନ କରିବା ପାଇଁ ସମର୍ଥ ହୋଇଥାଏ ।
ଅନ୍ୟ ମୌଳିକ ଯଥା – ଅକ୍ସିଜେନ୍, ହାଇଡ୍ରୋଜେନ୍, ନାଇଟ୍ରୋଜେନ୍, ସଲଫର୍, କ୍ଲୋରିନ୍ ଇତ୍ୟାଦି ସହ କାର୍ବନ୍ର ଯୌଗିକ ସୃଷ୍ଟି ହୋଇଥାଏ ।
ଏହି ଯୌଗିକଗୁଡ଼ିକର ସୁନିର୍ଦ୍ଦିଷ୍ଟ (specific) ଧର୍ମ ରହିଥାଏ । ଏହି ଧର୍ମଗୁଡ଼ିକ ଅଣୁରେ ଥିବା କାର୍ବନ ଛଡ଼ା ଅନ୍ୟ ମୌଳିକଗୁଡ଼ିକ ଉପରେ ନିର୍ଭର କରେ ।
→ (iii) ବିଭିନ୍ନ ପ୍ରକାରର ସହସଂଯୋଜ୍ୟ ବନ୍ଧ ଗଠନ କରିବା ପ୍ରୟାସ:
କାର୍ବନର ପରମାଣୁର ଆକାର ଛୋଟ ହେତୁ ବିଭିନ୍ନ ପ୍ରକାର ଶକ୍ତ ବନ୍ଧ ଗଠନ କରେ ।
ସହଭାଜିତ ଇଲେକ୍ଟ୍ରନ ଯୁଗଳକୁ ଶକ୍ତଭାବରେ ଧରି ରଖୁବା ପାଇଁ ଏହା ନ୍ୟୁକ୍ଲିୟସ୍ ସମର୍ଥ କରିଥାଏ ।
→ (iv) ଆଇସୋମେରିଜିମ୍ :
ଯେଉଁ ଯୌଗିକଗୁଡ଼ିକର ଏକା ଅଣୁ ସଙ୍କେତ ଥାଏ କିନ୍ତୁ ଅଣୁ ଭିତରେ ପରମାଣୁ ସଜ୍ଜା ପୃଥକ୍ ପୃଥକ୍ ହୋଇଥାଏ ସେହି ଯୌଗିକଗୁଡ଼ିକୁ ସଂରଚନାତ୍ମକ ଆଇସୋମର କୁହାଯାଏ ।
→ ଉଦାହରଣ :

ଅନେକ ଯୌଗିକରେ ସମାନ ଅଣକାର୍ବନ କିମ୍ବା ପରମାଣୁପୁଞ୍ଜ ବିଭିନ୍ନ କାର୍ବନ ଶୃଙ୍ଖଳ ସହିତ ସଂଯୁକ୍ତ ହୋଇରହିଥାଏ । ଆରମ୍ଭରେ ଏହିସବୁ ଯୌଗିକରେ ସମାନ ଅଣକାର୍ବନ କିମ୍ବା ପରମାଣୁ ପୁଞ୍ଜ ବିଭିନ୍ନ କାର୍ବନ ଶୃଙ୍ଖଳ ସହିତ ସଂଯୁକ୍ତ ହୋଇରହିଥାଏ, ଆରମ୍ଭରେ ଏହିସବୁ ଯୌଗିକ ପ୍ରାକୃତିକ ପଦାର୍ଥରୁ ନିଷ୍କାସିତ ହେଉଥିଲେ ଏବଂ ଧାରଣାଥିଲା ଯେ ଏଗୁଡ଼ିକ କେବଳ ଜୀବନ୍ତ ପଦାର୍ଥ ମଧ୍ୟରେ ପ୍ରସ୍ତୁତ ହୋଇପାରେ । ଫ୍ରେଡ୍ରିକ୍ ଭୋଲର୍ (Friedrich Wohler) 1828 ମସିହାରେ ଏମୋନିୟମ୍ ସିଆନେଟ୍ରୁ ୟୁରିଆ ପ୍ରସ୍ତୁତ କରି ଏହାକୁ ଖଣ୍ଡନ (disprove) କରିଥିଲେ ।
→ ହାଇଡ୍ରୋକାର୍ବନ (Hydrocarbon):
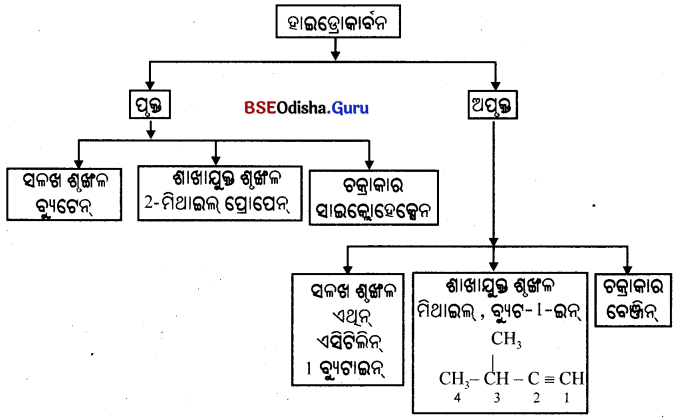
- ଯେଉଁ ସବୁ କାର୍ବନ ଯୌଗିକରେ କେବଳ କାର୍ବନ ଓ ହାଇଡ୍ରୋଜେନ୍ ରହିଛି ସେଗୁଡ଼ିକୁ ହାଇଡ୍ରୋକାର୍ବନ କୁହାଯାଏ । ଏହା ଦୁଇ ପ୍ରକାର; ଯଥା – ପୃକ୍ତ ଓ ଅପୃକ୍ତ ହାଇଡ୍ରୋକାର୍ବନ ଯୌଗିକ ।
- ପୃକ୍ତ ହାଇଡ୍ରୋକାର୍ବନକୁ ଆଲ୍କେନ୍ (Alkane) କୁହାଯାଏ ।
- ଯେଉଁ ଅପୃକ୍ତ ହାଇଡ୍ରୋକାର୍ବନରେ ଏକ ବା ଅଧିକ ଦ୍ବି-ବନ୍ଧ ଥାଏ ତାକୁ ଆଲ୍କିନ୍ (Alkene) କୁହାଯାଏ ।
- ଏକା ବା ଅଧୂକ ତ୍ରିବନ୍ଧ ଥିବା ହାଇଡ୍ରୋକାର୍ବନକୁ ଆଲକାଇନ୍ (Alkyne) କୁହାଯାଏ ।
![]()
→ ପୃକ୍ତ କାର୍ବନ ଯୌଗିକ :
- ଯେଉଁ ହାଇଡ୍ରୋକାର୍ବନ ଯୌଗିକଗୁଡ଼ିକରେ କାର୍ବନ କାର୍ବନ ମଧ୍ୟରେ ଗୋଟିଏ ଲେଖାଏଁ
- ସହସଂଯୋଜ୍ୟ ବନ୍ଧ ଥାଏ, ସେଗୁଡ଼ିକୁ ପୃକ୍ତ ହାଇଡ୍ରୋକାର୍ବନ ଯୌଗିକ କୁହାଯାଏ ।
- ଏହି ଯୌଗିକଗୁଡ଼ିକରେ ପ୍ରତ୍ୟେକ କାର୍ବନ ପରମାଣୁ ଅନ୍ୟ ଚାରୋଟି ପରମାଣୁସହ ବନ୍ଧ ଗଠନ କରିଥାଏ ।
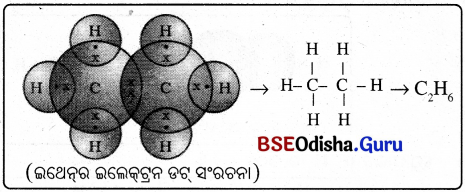
- ସରଳତର ପୃକ୍ତ ହାଇଡ୍ରୋକାର୍ବନ ହେଉଛି, ମିଥେନ୍ (CH4), ଇଥେନ୍ (C2H6) |
- କାର୍ବନ ପରମାଣୁଗୁଡ଼ିକ ଏକ ବନ୍ଧ ସହ ଏକା ସଙ୍ଗରେ ସଂଯୁକ୍ତ କରାଯାଉ । C – C
- ପ୍ରତି କାର୍ବନ ପରମାଣୁର ବାକି ତିନୋଟି ଯୋଗ୍ୟତା ଅସଂପୂର୍ଣ୍ଣ ରହିଛି । ତେଣୁ ପ୍ରତି କାର୍ବନକୁ ତିନୋଟି ହାଇଡ୍ରୋଜେନ୍ ପରମାଣୁ ସହ ବନ୍ଧ କରାଯାଉ ।
→ ଇଥେନ୍ (CH )ର ଗଠନ :
ଯୌଗିକଗୁଡ଼ିକ ସାଧାରଣତଃ ବେଶି ପ୍ରତିକ୍ରିୟାଶୀଳ ନୁହେଁ । ପୃକ୍ତ ଯୌଗିକଗୁଡ଼ିକର ସାଧାରଣ ଅଣୁ ସଙ୍କେତ CnH2n+2
→ ଅପୃକ୍ତ କାର୍ବନ ଯୌଗିକ :
ଯେଉଁ ହାଇଡ୍ରୋକାର୍ବନ ଯୌଗିକରେ କାର୍ବନ-କାର୍ବନ ମଧ୍ୟରେ ଦ୍ବି-ବନ୍ଧ କିମ୍ବା ତ୍ରି-ବନ୍ଧ ଥାଏ, ସେଗୁଡ଼ିକୁ ଅପୃକ୍ତ କାର୍ବନ ଯୌଗିକ କୁହାଯାଏ । ଏହି ଯୌଗକଗୁଡ଼ିକରେ କାର୍ବନ ପରମାଣୁଗୁଡ଼ିକ ଗୋଟିଏ ଲେଖାଏଁ ସହସଂଯୋଜ୍ୟ ବନ୍ଧ ଗଠନ କରି ସେମାନଙ୍କ ସମ୍ପୂର୍ଣ୍ଣ ସଂଯୋଜନ କ୍ଷମତା ଉପଯୋଗ କରୁ ନ ଥିବାରୁ ସେଗୁଡ଼ିକ ଅପୃକ୍ତ ହୋଇଥା’ନ୍ତି ।
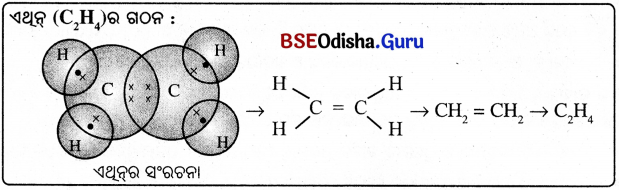
(i) ଆଲ୍କିନ୍ : ଯେଉଁ ହାଇଡ୍ରୋକାର୍ବନ ଯୌଗିକଗୁଡ଼ିକର କାର୍ବନ କାର୍ବନ ମଧ୍ୟରେ ଦୁଇଟି ଲେଖାଏଁ ବନ୍ଧ ଥାଏ । ସେଗୁଡ଼ିକୁ ଆଲ୍କିନ୍ କୁହାଯାଏ ।
ଉଦାହରଣ :
ଏଥୁନ୍ (C2H4), ପ୍ରୋପିନ୍ (C3H5), ବ୍ୟୁଟିନ୍ (C4H8) ଇତ୍ୟାଦି ।
(ii) ଆଲ୍କାଇନ୍ :
ଯେଉଁ ହାଇଡ୍ରୋକାର୍ବନ୍ଗୁଡ଼ିକରେ କାର୍ବନ କାର୍ବନ ମଧ୍ୟରେ ତିନୋଟି ଲେଖାଏଁ ବନ୍ଧ ଥାଏ, ସେଗୁଡ଼ିକୁ ଆଲ୍କାଇନ୍ କୁହାଯାଏ ।
( – C = C -)
→ ଉଦାହରଣ :
- ଇଥାଇନ୍ (C2H2), ପ୍ରୋପାଇନ୍ (C3H4), ବ୍ୟୁଟାଇନ୍ (C4H8) ଇତ୍ୟାଦି ।
- ଅପୃକ୍ତ କାର୍ବନ ଯୌଗିକ ଗୁଡ଼ିକ ପୃକ୍ତ କାର୍ବନ ଯୌଗିକଠାରୁ ଅଧିକ ପ୍ରତିକ୍ରିୟାଶୀଳ ।
- ଦ୍ବି-ବନ୍ଧଥିବା ଅପୃକ୍ତ କାର୍ବନ ଯୌଗିକର ସାଧାରଣ ଅଣୁ ସଂକେତ : CnH2n
- ଯେଉଁ ଅପୃକ୍ତ ହାଇଡ୍ରୋକାର୍ବନରେ ଏକ ବା ଅଧୂକ ତ୍ରିବନ୍ଧ ଥବ ସେହି ହାଇଡ୍ରୋକାର୍ବନକୁ ଆଲକାଇନ୍ କୁହାଯାଏ । ଏହାର ସାଧାରଣ ଅଣୁ ସଙ୍କେତ : CnH2n-2
(i) ଇଥାଇନ୍ (C2H2)ର ଗଠନ :

(ii)
ପ୍ରୋପାଇନ୍ (C3H4)ର ଗଠନ :

→ ଶୃଙ୍ଖଳ, ଶାଖା ଏବଂ ଚକ୍ରାକାର (Chains, Branches & Rings) :
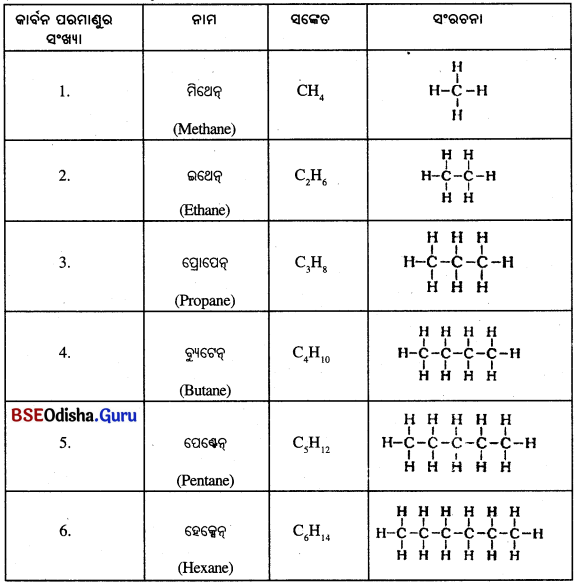
→ (a) ସଳଖ ଚେନ୍ ବା ଶୃଙ୍ଖଳ ଯୁକ୍ତ ଯୌଗିକ :
ଯେଉଁ ଆଲକେନ୍ଗୁଡ଼ିକରେ ତିନୋଟି କିମ୍ବା କମ୍ କାର୍ବନ ପରମାଣୁ ଥାଏ, ସେଗୁଡ଼ିକ ଶାଖା ଗଠନ କରନ୍ତି ନାହିଁ ।
(i) ମିଥେନ୍ , ଇଥେନ୍ ଓ ପ୍ରୋପେନ୍ ଯଥାକ୍ରମେ 1, 2 ଓ 3 କାର୍ବନ ପରମାଣୁ ରହିଥିବା କାର୍ବନ ଯୌଗିକ । କାର୍ବନ ପରମାଣୁର ଏହିଭଳି ଚେନ୍ ବା ଶୃଙ୍ଖଳ ଚେନ୍ରେ ବହୁସଂଖ୍ୟକ କାର୍ବନ ପରମାଣୁ ରହିପାରିବ ।
କାର୍ବନ ଓ ହାଇଡ୍ରୋଜେନର ପୃକ୍ତ ଯୌଗିକର ସଙ୍କେତ ଓ ସଂରଚନା
→ (b) ଶାଖାଯୁକ୍ତ ପୌଟିଜ :
ବ୍ଲ୍ୟୁଟେନ୍ (C4H10 ) ର ସଂରଚନା:
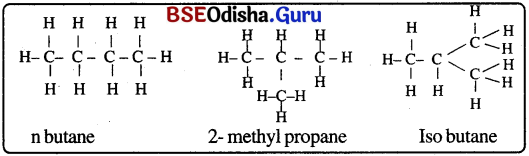
ଯେଉଁ ଯୌଗିକଗୁଡ଼ିକର ଏକା ଅଣୁ ସଙ୍କେତ ସମାନ ଥାଏ, କିନ୍ତୁ ଅଣୁଭିତରେ ପରମାଣୁ ସଜ୍ଜା ପୃଥକ୍ ହୋଇଥାଏ ସେହି ଯୌଗିକଗୁଡ଼ିକୁ ସଂରଚନାତ୍ମକ ଆଇସୋମର (structural isomer) କହନ୍ତି ।
![]()
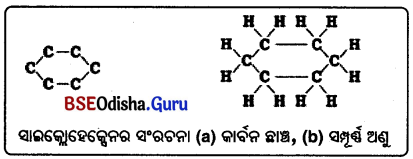
→ (C) ଚକ୍ରୀୟ କାର୍ବନ ଯୌଗିକ :
ଯେଉଁ କାର୍ବନ ଯୌଗିକରେ କାର୍ବନ ପରମାଣୁ ଗୁଡ଼ିକ ରିଙ୍ଗପରି ବା ଚକ୍ରାକାରରେ ସଜ୍ଜିତ ହୋଇଥାଏ, ତାହାକୁ ଚକ୍ରୀୟ କାର୍ବନ ଯୌଗିକ କହନ୍ତି । ହାଇଡ୍ରୋକାର୍ବନଗୁଡ଼ିକରେ ତିନୋଟି କିମ୍ବା ତହିଁରୁ ଅଧ୍ବକ କାର୍ବନ ପରମାଣୁ ଉପରେ ଚକ୍ରାକାର ଚେନ୍ ସମ୍ଭବ ହୋଇଥାଏ ।
(i) ସାଇକ୍ଲୋହେକ୍ସନ୍ (C6H12) ର ସଂରଚନା:
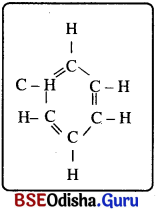
(ii) ବେଞ୍ଜିନ୍ (C6H6) ରେ ସଂରଚନା:
→ କାର୍ବନ ସହିତ ବହୁତ| (Will you be my friends):
- କାର୍ବନ ଏକ ଖୁବ୍ ବନ୍ଧୁତ୍ଵପୂର୍ଣ ମୌଳିକ । ଏହା ହାଇଡ୍ରୋଜେନ୍ ବ୍ୟତୀତ ଅନ୍ୟ ମୌଳିକ ଯଥା – ହାଲୋଜେନ୍, ଅକ୍ସିଜେନ୍, ନାଇଟ୍ରୋଜେନ୍ ଏବଂ ସଲଫର୍ ସହିତ ମଧ୍ୟ ବନ୍ଧ ଗଠନ କରେ ।
- ଏକ ହାଇଡ୍ରୋକାର୍ବନ ଶୃଙ୍ଖଳରେ ଏକ ବା ଅଧିକ ହାଇଡ୍ରୋଜେନ୍ର ସ୍ଥାନ ଏହି ମୌଳିକଦ୍ଵାରା ପୂରଣ ହୁଏ ଏବଂ କର୍ଜନର ଯୋଗ୍ୟତା ସମ୍ପୂର୍ଣ୍ଣ ହୋଇଥାଏ ।
ଏହି ଭଳି ଯୌଗିକଟୁଡ଼ିକରେ ହାଲଡ୍ରୋଜେନ୍ ବଦଳରେ ଅନ୍ୟ ଯେଉଁ ମୌଳିକର ପରମାଣୁ ସ୍ଥାନ ନିଏ ତାହାକୁ ଅସମ ପରମାଣୁ (Heteroatom) କୁହାଯାଏ । - ଅସମ ପରମାଣୁ ଏବଂ ଅସମ ପରମାଣୁ ରହିଥିବା ଗ୍ରୁପ ଯୌଗିକକୁ ସ୍ୱତନ୍ତ୍ର ଧର୍ମ ପ୍ରଦାନ କରେ । ଏଗୁଡ଼ିକୁ ସକ୍ରିୟ ଗ୍ରୁପ୍ (Functional Group) କୁହାଯାଏ ।
- ଗୋଟିଏ କାର୍ବନ ଯୌଗିକର ଧର୍ମ ତାହାର ସକ୍ରିୟ ଗ୍ରୁପ୍ ଉପରେ ନିର୍ଭର କରେ, କାର୍ବନଶୃଙ୍ଖଳର ଦୀର୍ଘତା ଓ ପ୍ରକୃତି ଉପରେ ନୁହେଁ ।
ଏକ ବା ଅଧିକ ହାଇଡ୍ରୋଜେନ ପରମାଣୁର ସ୍ଥାନ ସକ୍ରିୟ ଗ୍ରୁପ ଦ୍ୱାରା ପ୍ରତିସ୍ଥାପିତ ହୋଇ ଏହି ଯୋଗ୍ଯତା ମଧ୍ୟଦେଇ କାର୍ବନ ଶୃଙ୍ଖଳ ସହିତ ସଂଯୋଗ୍ୟ ହୋଇଥାଏ ।
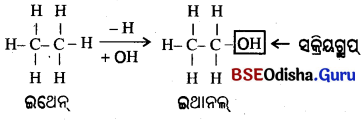
କାର୍ବନ ଯୋଗିକରେ କେତୋଟି ସକ୍ରିୟ ଗ୍ରୁପ :
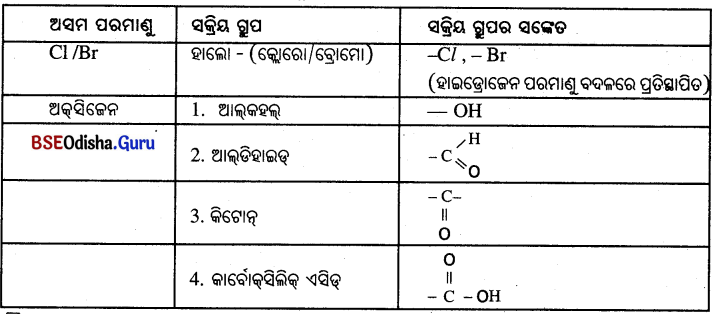
→ ହୋମୋଲୋଗସ୍ ଶ୍ରେଣୀ (Homologous Series):
ସକ୍ରିୟ ଗ୍ରୁପର ଉପସ୍ଥିତି କାର୍ବନ ଯୌଗିକର ଧର୍ମଗୁଡ଼ିକ ଜାହିର କରିଥାଏ ।
→ ଉଦାହରଣ:
- CH3OH, C2H5OH, C3H7OH ଓ C4H9OH ଇତ୍ୟାଦି ଗୁଡ଼ିକର ରାସାୟନିକ ଧର୍ମ ସମାନ କାରଣ ଏଗୁଡ଼ିକର ସକ୍ରିୟ ଗ୍ରୁପ୍ ସମାନ ।
ଯୌଗିକ ଶ୍ରେଣୀର ଯେଉଁଥରେ ଏକା ସକ୍ରିୟ ଗ୍ରୁପ କାର୍ବନ ଶୃଙ୍ଖଳର ହାଇଡ୍ରୋଜେନ ପାଇଁ ପ୍ରତିସ୍ଥାପିତ ହୋଇଥାଏ ତାକୁ ସଜାତୀୟ ବା ହୋମୋଲଗସ୍ ଶ୍ରେଣୀ କୁହାଯାଏ । ପ୍ରତ୍ୟେକ ଯୌଗିକକୁ ହୋମଲୋଗ୍ କହନ୍ତି । - ସମାନ ସଂରଚନା ଓ ସମାନ ରାସାୟନିକ ଧର୍ମବିଶିଷ୍ଟ ଗୋଟିଏ ଜୈବ ଯୌଗିକ ଶ୍ରେଣୀରେ ଗୋଟିଏ ଯୌଗିକ ତା’ର ପୂର୍ବବର୍ତ୍ତୀ ପରବର୍ତ୍ତୀ ଓ ଯୌଗିକ ଠାରୁ ତା’ର ଆଣବିକ ସଂକେତରେ – CH2 ଗ୍ରୁପ୍ ଦ୍ଵାରା ପୃଥକ୍ ହୋଇଥିଲେ, ସେହି ଶ୍ରେଣୀକୁ ହୋମୋଲଗସ୍ ଶ୍ରେଣୀ କୁହାଯାଏ ।
![]()
→ ହୋମୋଲୋଗ୍ ଶ୍ରେଣୀର ଗୁଣ (ପ୍ରକୃତି) :
(i) ହୋମୋଲଗ୍ନ ଶ୍ରେଣୀର ପ୍ରତ୍ୟେକ ହୋମୋଲଗ୍ର ସାଧାରଣ ଅଣୁ ସଂକେତ ଅଛି । ସଂରଚନା ମଧ୍ୟ ସମାନ । ଉଦାହରଣ ମିଥେନ୍ – CH4, ଇଥେନ୍ – C2H6, ପ୍ରୋପେନ୍ – C3H8 , ବ୍ୟୁଟେନ – C4H10 ଇତ୍ୟାଦି ।
ଆଲକେନ୍ର ସାଧାରଣ ଅଣୁ ସଙ୍କେତ CnH2n+2
ଆଲ୍କିନ୍ର ସାଧାରଣ ଅଣୁ ସଙ୍କେତ CnH2n |
ଆଲକାଇନ୍ର ସାଧାରଣ ଅଣୁ ସଙ୍କେତ CnH2n-2 |
(ii) ଉପରୋକ୍ତ ଉଦାହରଣରେ କ୍ରମାନ୍ୱୟରେ ଥିବା ଯୌଗିକ ଗୁଡ଼ିକ –CH2 ଏକକ ଦ୍ଵାରା ପୃଥକ୍ । CH4 ଓ C2H6 ଇତ୍ୟାଦି ।
(iii) କ୍ରମାନ୍ୱୟରେ ଥିବା ଯୌଗିକ ଗୁଡ଼ିକର ଆଣବିକ ବସ୍ତୁତ୍ଵ ମଧ୍ଯରେ 14u ପାର୍ଥକ୍ୟ ଥାଏ ।
CH4 ର ଆଣବିକ ବସ୍ତୁତ୍ଵ = 12 x 1 + 4 × 1 = 16u
C2H6 ର ଆଣବିକ ବସ୍ତୁତ୍ଵ = 12 × 2 + 6 × 1 = 30 u
CH4 ଓ C2H6 ର ଆଣବିକ ବସ୍ତୁତ୍ୱ ମଧ୍ଯରେ ପାର୍ଥକ୍ୟ 14 u
(iv) କୌଣସି ହୋମୋଲୋଗସ୍ ଶ୍ରେଣୀରେ ଆଣବିକ ବସ୍ତୁତ୍ଵ ବୃଦ୍ଧି ଘଟିବା ସହ ଭୌତିକ ପ୍ରକୃତିରେ ଏକ କ୍ରମ ବିନ୍ୟାସ (Gradation) ଦେଖାଯାଏ ।
(v) ଗଳନାଙ୍କ ଓ ସ୍ଫୁଟନାଙ୍କ ବୃଦ୍ଧି ଘଟେ ।
(vi) ନିର୍ଦ୍ଦିଷ୍ଟ ଦ୍ରାବକରେ ଦ୍ରବଣୀୟ ହୋଇଥାଏ ।
(vii) ରାସାୟନିକ ଧର୍ମ ସମାନ ରହେ ।
→ କାର୍ବନ ଯୌଗିକଗୁଡ଼ିକର ନାମକରଣ ପଦ୍ଧତି (Nomenclature of carbon compounds):
- ହୋମୋଲଗସ୍ ଶ୍ରେଣୀରେ ଯୌଗିକଗୁଡ଼ିକର ନାମ ମୂଳ କାର୍ବନ ଶୃଙ୍ଖଳ ଉପରେ ନିର୍ଭର କରେ ।
- ଶୃଙ୍ଖଳର ନାମ ପୂର୍ବରେ କିମ୍ବା ଶେଷରେ ସକ୍ରିୟ ଗ୍ରୁପର ପ୍ରକୃତି ସୂଚାଉଥିବା ଏକ ଶତାଂଶ ଯୋଗ କରି ଏବଂ ଶୃଙ୍ଖଳର ନାମକୁ ସାମାନ୍ୟ ପରିବର୍ତ୍ତନ କରି ଯୌଗିକର ନାମକରଣ କରାଯାଏ ।
→ ନିମ୍ନଲିଖୂତ ପଦ୍ଧତି ଦ୍ଵାରା କାର୍ବନ ଯୌଗିକର ନାମକରଣ କରାଯାଇପାରିବ ।
- ଯୌଗିକଟିରେ କାର୍ବନ ସଂଖ୍ୟା ଚିହ୍ନଟ କର । ତିନୋଟି କାର୍ବନ ପରମାଣୁ ରହିଥିବା ଯୌଗିକର ନାମ ପ୍ରୋପେନ୍ ହୋଇଥା’ନ୍ତା ।
- ସକ୍ରିୟ ଗ୍ରୁପ୍ ଥିଲେ ଯୌଗିକର ନାମର ପୂର୍ବରେ କିମ୍ବା ନାମର ଶେଷ ଭାଗରେ ଏକ ଶତାଂଶ ଯୋଗକରି ସକ୍ରିୟ ଗ୍ରୁପ୍କୁ ସୂଚାଯାଏ ।
- ସକ୍ରିୟ ଗ୍ରୁପର ନାମକୁ ଯଦି ଶେଷଭାଗରେ ସୂଚାଇବାକୁ ହେବ ଇଂରାଜୀ ନାମର ଶେଷଭାଗରେ ଥିବା ‘e’ କୁ ବାଦଦେଇ ଏବଂ ସେହିସ୍ଥାନରେ ଉପଯୁକ୍ତ ଶତାଂଶଟି ଶେଷଭାଗରେ ଯୋଗକରି କାର୍ବନଶୃଙ୍ଖଳର ନାମକୁ ସାମାନ୍ୟ ପରିବର୍ତ୍ତନ କରାଯାଏ । ଉଦାହରଣସ୍ୱରୂପ, ଗୋଟିଏ କିଟୋଗ୍ରୁପ ସହ ଏକ ତିନି କାର୍ବନ ବିଶିଷ୍ଟ ଶୃଙ୍ଖଳକୁ ନିମ୍ନ ପ୍ରକାରରେ ନାମିତ କରାଯିବ ।
ପ୍ରୋପେନ୍ – ‘e’ = ପ୍ରୋପାନ୍ + ‘ଓନ୍’ = ପ୍ରୋପାନୋନ୍
(Propane – ‘e’ = Propan + ‘one’ = Propanone) - କାର୍ବନ ଶୃଙ୍ଖଳଟି ଯଦି ଅପୃକ୍ତ, ତେବେ କାର୍ବନ ଶୃଙ୍ଖଳ ନାମର ଶେଷଭାଗରେ ଥିବା ଇଂରାଜୀ ଶବ୍ଦାଶ ‘ane’ସ୍ଥାନରେ ‘ene’ କିମ୍ବା ‘yne’ ପ୍ରତିସ୍ଥାପନ କରାଯାଏ । ଉଦାହରଣସ୍ୱରୂପ, ଗୋଟିଏ ଦ୍ଵିବନ୍ଧ ସହ ତିନି କାର୍ବନ ବିଶିଷ୍ଟ ଶୃଙ୍ଖଳକୁ ପ୍ରୋପିନ୍ (Propene) କୁହାଯିବ । ଯଦି ଏହି ଶୃଙ୍ଖଳରେ ତ୍ରିବନ୍ଧ ରହେ, ଏହାକୁ ପ୍ରୋପାଇନ୍ (Propyne) କୁହାଯିବ ।
→ କାର୍ବନ ଯୌଗିକର ରାସାୟନିକ ଧର୍ମ (Chemical Properties of Carbon Compounds):
→ (a) ଦହନ (Combustion):
- କାର୍ବନର ଯେକୌଣସି ରୂପ ଅକ୍ସିଜେନରେ ଜଳିଲେ କାର୍ବନ ଡାଇଅକ୍ସାଇଡ୍ ସୃଷ୍ଟି ହେବା ସହିତ ତାପ ଓ ଆଲୋକ ନିର୍ଗତ ହୋଇଥାଏ ।
- ଅଧିକାଂଶ କାର୍ବନ ଯୌଗିକ ଦହନ ପ୍ରତିକ୍ରିୟାରେ ବହୁପରିମାଣର ତାପଶକ୍ତି ଓ ଆଲୋକଶକ୍ତି ସୃଷ୍ଟି କରିଥାନ୍ତି । ଏହାକୁ ଜାରଣ ପ୍ରତିକ୍ରିୟା କହନ୍ତି ।
→ ଉଦାହରଣ :
- C + O2 → CO2 + ତାପ ଏବଂ ଆଲୋକ
- CH4 + O2 → CO2 + H2O + ଚାପ ଓ ଆଲୋକ
- CH3CH2OH + O2 → CO2 + H2O + ଚାପ ଓ ଆଲୋକ
→ ଶେଷ ଦୁଇଟି ପ୍ରତିକ୍ରିୟାକୁ ସମତୁଲ କର ।
ଉ :
CH4 + 2O2 → CO2 + 2H2O + ଚାପ ଓ ଆଲୋକ
CH3CH2OH + 3O2 → 2CO2 + 3H2O + ଚାପ ଓ ଆଲୋକ
- ପୃକ୍ତ ହାଇଡ୍ରୋକାର୍ବନ ଯୌଗିକ; ଯଥା – ମିଥେନ୍, ଇଥେନ୍, ପ୍ରାକୃତିକ ଗ୍ୟାସ୍, LPG, କର୍ପୂର, ଆଲକହଲ ବାୟୁରେ ଜଳିଲେ ସ୍ଵଚ୍ଛଶିଖା (Clean Flame) ଦେଇଥାଏ ।
- ଅପୃକ୍ତ ହାଇଡ୍ରୋକାର୍ବନ ଯୌଗିକ; ଯଥା— ଇଥ, ଗନ୍ଧକର୍ପୂର, ବେଞ୍ଜିନ୍ ଇତ୍ୟାଦି ଜଳିଲେ କଳା ଧୂଆଁ ସହିତ ହଳଦିଆ ରଙ୍ଗର ଶିଖା ହେବ ।
- ଗୋଟିଏ ଧାତବ ଥାଳି ରଖୁ କଳା କଣିକା ଥାଳି ଉପରେ ଜମିଯିବ । ବାୟୁର ଯୋଗାଣକୁ ସୀମିତ କରିଦେଲେ
- ଘରଗୁଡ଼ିକରେ ବ୍ୟବହୃତ ହେଉଥିବା ଗ୍ୟାସ୍, କିରୋସିନ୍ ଷ୍ଟୋଭରେ ବାୟୁ ପାଇଁ ପ୍ରବେଶ ପଥ (Inlet) ଥାଏ, ଫଳରେ ଯଥେଷ୍ଟ ପରିମାଣର ଅକ୍ସିଜେନଯୁକ୍ତ (Oxygen rich) ମିଶ୍ରଣ ଏକ ସ୍ବଚ୍ଛ ନୀଳ ଶିଖା ଦେଇଥାଏ ।
- ଯଦି ରନ୍ଧାପାତ୍ର କଳା ହୋଇଥାଏ ତେବେ ବାୟୁଛିଦ୍ର (airholes) ଗୁଡ଼ିକର ପଥ ଅବରୁଦ୍ଧ ହୋଇଯାଉଛି ଓ ଜାଳେଣୀ ନଷ୍ଟ ହେଉଛି ।
![]()
→ ତୁମେ ଜାଣିଛ କି ?
ଶିଖା କିମ୍ବା ବିନାଶିଖା ସହ ପଦାର୍ଥଗୁଡ଼ିକ କାହିଁକି ଜଳେ ?
- ଗୋଟିଏ ମହମବତୀ କିମ୍ବା ଗ୍ୟାସ୍ଟ୍ରୋଭରେ ଏଲ୍ପିଜି (LPG) ଏକ ଶିଖାସହ ଜଳେ । ଚୁଲିରେ କୋଇଲା କିମ୍ବା ଅଙ୍ଗାର (Charcoal) କେବଳ ନାଲିରଙ୍ଗରେ ଉଜ୍ଜ୍ବଳ ହୋଇ ଏବଂ ବିନାଶିଖାରେ ତାପ ନିର୍ଗତ କରିଥାଏ । ଏହାର କାରଣ ହେଲା, କେବଳ ଗ୍ୟାସୀୟ ପଦାର୍ଥ ଜଳିଲେ ଶିଖା ସୃଷ୍ଟି ହୋଇଥାଏ । କିନ୍ତୁ କାଠ କିମ୍ବା ଅଙ୍ଗାରକୁ ଜାଳିଲେ, ଏଥିରେ ଥିବା ଉଦ୍ୟୀ ପଦାର୍ଥଗୁଡ଼ିକ ବାଷ୍ପରେ ପରିଣତ ହୁଏ ଏବଂ ପ୍ରଥମେ ଶିଖାସହ ଜଳେ ।
- ଗ୍ୟାସୀୟ ପଦାର୍ଥର ପରମାଣୁଗୁଡ଼ିକ ଉତ୍ତପ୍ତ ହେଲେ ଆଲୋକ ଓ ତାପ ବିକିରଣ କରିବାକୁ ଆରମ୍ଭ କରେ ଓ ପ୍ରଦୀପ୍ତ ଶିଖା (Luminous) ଦେଖାଯାଏ । ପ୍ରତି ମୌଳିକଦ୍ୱାରା ସୃଷ୍ଟ ବର୍ଣ୍ଣ ସେହି ମୌଳିକର ସ୍ବଭାବସିଦ୍ଧ (Characteristic) ଗୁଣ ।
→ କୋଇଲା ଏବଂ ପେଟ୍ରୋଲିୟମର ସୃଷ୍ଟି :
(i) ବିଭିନ୍ନ ପ୍ରକାର ଜୈବିକ ଏବଂ ଭୂତାନ୍ତ୍ରିକ (Biological and Geological ) ପ୍ରକ୍ରିୟା ଯୋଗୁଁ ଜୈବ ବସ୍ତୁତ୍ଵରୁ କୋଇଲା ଏବଂ ପେଟ୍ରୋଲିୟମ ସୃଷ୍ଟି ହୋଇଛି । ନିୟୁତ ନିୟୁତ ବର୍ଷପୂର୍ବେ ଜୀବିତ ଥିବା ଗଛ, ଫର୍ଶ ଏବଂ ଅନ୍ୟ ଉଦ୍ଭଦଗୁଡ଼ିକର ମୃତ ଦେହାବଶେଷ ହେଉଛି କୋଇଲା । ସମ୍ଭବତଃ ଭୂମିକମ୍ପ କିମ୍ବା ଆଗ୍ନେୟଗିରି ଉଦ୍ଗୀରଣ ଦ୍ଵାରା ଏଗୁଡ଼ିକ ପୋତି ହୋଇଗଲା । ମାଟି ଓ ପଥରର ସ୍ତରଗୁଡ଼ିକ ତଳେ ଚାପି ହୋଇ ରହିଲା । ଆସ୍ତେ ଆସ୍ତେ କ୍ଷୟପ୍ରାପ୍ତ ହୋଇ ସେଗୁଡ଼ିକ କୋଇଲାରେ ପରିଣତ ହେଲା ।
(ii) ସମୁଦ୍ରରେ ଥିବା ନିୟୁତ ନିୟୁତ କ୍ଷୁଦ୍ର ଉଭିଦ ଏବଂ ପ୍ରାଣୀର ମୃତ ଦେହାବଶେଷରୁ ତୈଳ ଏବଂ ଗ୍ୟାସ୍ର ସୃଷ୍ଟି । ମୃତ୍ୟୁପରେ ସେଗୁଡ଼ିକର ଦେହାବଶେଷ ସମୁଦ୍ର ଶଯ୍ୟା ତଳକୁ ବୁଡ଼ିଗଲା ଏବଂ ପଟୁଦ୍ୱାରା ଆଚ୍ଛାଦିତ ହୋଇଗଲା । ଉଚ୍ଚ ଚାପରେ ଥିବା ମୃତ ଅବଶେଷକୁ ବୀଜାଣୁ ଆକ୍ରମଣ କରି ସେଗୁଡ଼ିକୁ ତୈଳ ଓ ଗ୍ୟାସ୍ରେ ପରିଣତ କରିଦେଲା । ଏହି ସମୟ ମଧ୍ୟରେ ଚାପଦ୍ଵାରା ପଟୁ ଆସ୍ତେ ଆସ୍ତେ ଶିଳାରେ ପରିଣତ ହେଲା । ଶିଳାରେ ଥୁବା ଛିଦ୍ରଅଂଶଗୁଡ଼ିକ ମଧ୍ୟକୁ ତୈଳ ଓ ଗ୍ୟାସ୍ ବହିଗଲା ଏବଂ ସଞ୍ଚିତ ହୋଇ ରହିଲା ।
→ (b) ଜାଗଣ (Oxidation) :
କାର୍ବନ ଯୌଗିକଗୁଡ଼ିକ ଦହନଦ୍ୱାରା ସହଜରେ ଜାରିତ ହୋଇଥାନ୍ତି । ଏହି ସମ୍ପୂର୍ଣ ଜାରଣ ଛଡ଼ା ଅନେକ ପ୍ରତିକ୍ରିୟା ଅଛି ଯେଉଁଥରେ ଆଲ୍କହଲ ଗୁଡ଼ିକ କାର୍ବୋକ୍ଲିକ୍ ଏସିଡ୍ରେ ପରିଣତ ହୁଏ ।
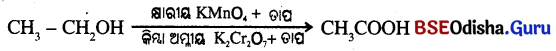
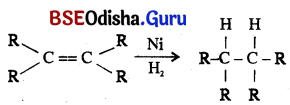
→ (c) ପୋଖ ପ୍ରତିକ୍ରିୟା (Addition reaction):
ଅପୃକ୍ତ ହାଇଡ୍ରୋକାର୍ବନ ଉତ୍ପ୍ରେରକ ଉପସ୍ଥିତିରେ ହାଇଡ୍ରୋଜେନ ସହ ଯୋଗ ପ୍ରତିକ୍ରିୟା କରି ପୃକ୍ତ ହାଇଡ୍ରୋକାର୍ବନ ଦେଇଥାଏ ।

ଦନସ୍ପତି ତେଲଗୁଡ଼ିକରେ ସାଧାରଣତଃ ଅପୃକ୍ତ କାର୍ବନ ଶୃଙ୍ଖଳ ଥିବା ବେଳେ ପଶୁ ଚର୍ବିରେ ପୃକ୍ତ କାର୍ବନ ଶୃଙ୍ଖଳ ରହିଥାଏ ।
→ (d) ପ୍ରତିସ୍ଥାପିତ ପ୍ରତିକ୍ରିୟା (Substitution reaction)
ସୂର୍ଯ୍ୟାଲୋକ ଉପସ୍ଥିତିରେ କ୍ଲୋରିନ୍ ଅତି ଦୃତ ପ୍ରତିକ୍ରିୟା କରି ହାଇଡ୍ରୋକାର୍ବନ ସହ ସଂଯୋଗ କରିଥାଏ । ଏହି ପ୍ରତିକ୍ରିୟାରେ ପୃକ୍ତ ହାଇଡ୍ରୋକାର୍ବନର ହାଇଡ୍ରୋଜେନ ପରମାଣୁ ସ୍ଥାନରେ କ୍ଲୋରିନ୍ ପରମାଣୁ ଗୋଟି ଗୋଟି ହୋଇ ପ୍ରତିସ୍ଥାପିତ ହୋଇଥାଏ । ଏହାକୁ ପ୍ରତିସ୍ଥାପନ ପ୍ରତିକ୍ରିୟା କୁହାଯାଏ ।
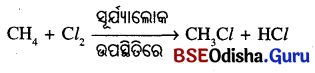
CH3CI + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
→ କେତୋଟି ପ୍ରଧାନ କାର୍ବନ ଯୌଗିକ-ଇଥାନଲ୍ ଏବଂ ଇଥାନୋଇକ୍ ଏସିଡ୍ (Some Important Carbon Compounds-Ethanol and Ethanoic acid) :
ଇଥାନଲାଭ ଧର୍ମ (Properties of Ethanol) :
- ପ୍ରକୋଷ୍ଠ ତାପମାତ୍ରାରେ ଇଥାନଲ ଏକ ତରଳ ଅଟେ ।
- ଏହାର ଗଳନାଙ୍କ 156K ଓ ସ୍ଫୁଟନାଙ୍କ 351K ।
- ଇଥାନଲ୍କୁ ସାଧାରଣତଃ ଆଲକହଲ କହନ୍ତି ଏବଂ ଏହା ସମସ୍ତ ଆଲ୍କୋହଲିକ୍ ପାନୀୟର ସକ୍ରିୟ ଉପାଦାନ (Active ingredient) ।
- ଏହା ଏକ ଉତ୍ତମ ଦ୍ରାବକ ହୋଇଥିବାରୁ ଏହାକୁ ଅନେକ ଔଷଧ (ଟିଙ୍କଚର ଆୟୋଡ଼ିନ୍, କାଶର ଔଷଧ (cough syrup) ଓ ଅନେକ ଟନିକ୍)ରେ ବ୍ୟବହାର କରାଯାଏ । ଏହା ମଧ୍ୟ ଜଳରେ ସବୁ ଅନୁପାତରେ ଦ୍ରବଣୀୟ ।
→ ରାସାୟନିକ ଧର୍ମ:
- ସୋଡ଼ିୟମ ସହ ପ୍ରତିକ୍ରିୟା:
- ସୋଡ଼ିୟମ୍ ଧାତୁ ଇଥାନଲ ସହିତ ପ୍ରତିକ୍ରିୟା କରି ହାଇଡ୍ରୋଜେନ ଗ୍ୟାସ୍ ନିର୍ଗତ କରେ ।

- ଇଥାନଲ ଅଧ୍ଵ ପରିମାଣ ଗାଢ଼ ସଲଫ୍ୟୁରିକ୍ ଏସିଡ୍ ସହ 443K ରେ ଉତ୍ତପ୍ତ କଲେ ଇଥାନଲ ଅଣୁରୁ ଗୋଟିଏ ଜଳ ଅଣୁ ବାହାରିଯାଇ ଏଥୁନ୍ ସୃଷ୍ଟି ହୁଏ ।