Odisha State Board BSE Odisha 10th Class Physical Science Notes Chapter 5 ମୌଳିକଗୁଡ଼ିକର ପର୍ଯ୍ୟାୟୀ ଶ୍ରେଣୀକରଣ will enable students to study smartly.
BSE Odisha Class 10 Physical Science Notes Chapter 5 ମୌଳିକଗୁଡ଼ିକର ପର୍ଯ୍ୟାୟୀ ଶ୍ରେଣୀକରଣ
→ ମୌଳିକଗୁଡ଼ିକର ଶ୍ରେଣୀକରଣ ପାଇଁ ପ୍ରାରମ୍ଭିକ ଉଦ୍ୟମ (Early Attempts at the Classification of Elements) :
- 1800 ମସିହା ବେଳକୁ ପ୍ରାୟ 30ଟି ମୌଳିକ ଆବିଷ୍କୃତ ହୋଇଥିଲା; କିନ୍ତୁ ଏବେ 118ଟି ମୌଳିକ ଥିବା ବୈଜ୍ଞାନିକମାନଙ୍କ ଦ୍ବାରା ଦର୍ଶାଯାଉଛି । ସେଥୁରୁ
- ଅନେକ (92ଟି) ମୌଳିକ ପ୍ରକୃତିରୁ ମିଳିଥାଏ ଏବଂ ବାକିତକ ମୌଳିକ କୃତ୍ରିମ ଅଟେ ।
- ମୌଳିକମାନଙ୍କର ଧର୍ମ ମଧ୍ୟରେ ଥିବା ସାମଞ୍ଜସ୍ୟ ଓ ପାର୍ଥକ୍ୟକୁ ବୈଜ୍ଞାନିକମାନେ ଜାଣିବା ନିମନ୍ତେ ସମଧର୍ମୀ
- ସଜୀକରଣକୁ ପର୍ଯ୍ୟାୟ ସାରଣୀ କୁହାଯାଏ । କିମ୍ବା ବିଭିନ୍ନ ମୌଳିକର ଧର୍ମର ସାମଞ୍ଜସ୍ୟ ଅନୁଯାୟୀ ଶ୍ରେଣୀ ବିଭକ୍ତ କରି ଯେଉଁ ତାଲିକା ପ୍ରସ୍ତୁତି କରାଯାଇଛି, ତାହାକୁ ପର୍ଯ୍ୟାୟ ସାରଣୀ କୁହାଯାଏ ।
- 1815 ମସିହାରେ ଉଇଲିୟମ୍ ପ୍ରାଉଟ୍ ଦର୍ଶାଇଥିଲେ ଯେ, ସମସ୍ତ ମୌଳିକମାନଙ୍କର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ (atomic mass) ହାଇଡ୍ରୋଜେନ୍ର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵର ଗୁଣିତକ ।
- ପ୍ରାଉଟ୍ ପ୍ରଥମ ଥର ପାଇଁ ସୂଚାଇଥିଲେ ଯେ, ସମସ୍ତ ମୌଳିକର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ ମଧ୍ଯରେ ଏକ ନିବିଡ଼ ସମ୍ପର୍କ ରହିଛି ।
→ ଡୁବେରିନର ଟ୍ରାଇ ଏତସମୂହ (Dobereiner’s Triads):
- ଜର୍ମାନ ରସାୟନବିତ୍ ଜେ. ଡବ୍ଲ୍ୟୁ, ଡୁବେରିନର 1817 ମସିହାରେ ଅନୁରୂପ ଧର୍ମ ଥିବା ମୌଳିକଗୁଡ଼ିକୁ ନେଇ ଗ୍ରୁପ୍ କରି ସଜାଇବାକୁ ଉଦ୍ୟମ କଲେ । ତିନୋଟି ଲେଖାଏଁ ମୌଳିକର କେତୋଟି ଗ୍ରୁପକୁ ବାଛିଲେ, ଏହି ଗ୍ରୁପଗୁଡ଼ିକୁ ସେ ଟ୍ରାଇଏଡ୍ (Triad) ବୋଲି କହିଲେ ।
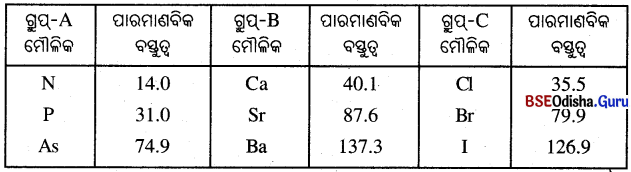
- ଡୁବେରିନର ଦର୍ଶାଇଥଲେ ଯେ, ପ୍ରତି ଟ୍ରାଇଏଡ୍ରେ ଥିବା ମୌଳିକଗୁଡ଼ିକୁ ସେମାନଙ୍କ ବର୍ଦ୍ଧିତ ପାରମାଣବିକ ବସ୍ତୁତ୍ୱ କ୍ରମରେ ସଜାଇଲେ ମଧ୍ଯସ୍ଥାନରେ ରହିଥିବା ମୌଳିକର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ ଅନ୍ୟ ଦୁଇଟି ମୌଳିକର ହାରାହାରି ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ ସଙ୍ଗେ ସମାନ । ଟ୍ରାଇଏଡ୍ ଗୁଡ଼ିକର ଉଦାହରଣ
![]()
→ ଉଦାହରଣ :
(i) କ୍ଷାରକ ଧାତୁ ଗ୍ରୁପ୍ : Ca, Sr ଓ Ba କ୍ଷାରକ ଧାତୁର ଗ୍ରୁପ୍ରେ ରହିଥା’ନ୍ତି ଏବଂ Ca, Sr ଓ Ba ଏକ ଟ୍ରାଏଡ୍ ଗଠନ କରନ୍ତି ।
Caର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ = 40.1 1
Srର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ = 87.6
Baର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ = 137.3
Ca ଓ Baର ହାରାହାରି ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ = \(\frac { 40.1+137.3 }{ 2 }\) = 88.7
ଏହା Sr ର ପାରମାଣବିକ ବସ୍ତୁତ୍ୱ ସହ ପ୍ରାୟ ସମାନ ।
(ii) କ୍ଷାର ଧାତୁ ଗ୍ରୁପ୍ : ଲିଥ୍ମ୍ (Li), ସୋଡ଼ିୟମ୍ (Na) ଏବଂ ପୋଟାସିୟମ୍ (K)ର ଜି.ରମାଣବିକ ବସ୍ତୁତ୍ୱ 6.6.9, 23.0 ଓ 39.0 1
Li ଓ K ର ହାରାହାରି ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ = \(\frac { 6.9+39-0 }{ 2 }\) = \(\frac { 45.9 }{ 2 }\) = 22.9
ଏହା Na ର ପାରମାଣବିକ ବସ୍ତୁତ୍ୱ ସହ ପ୍ରାୟ ସମାନ ।
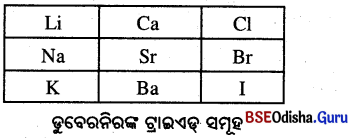
ସେତେବେଳେ ଜଣାଥବା ମୌଳିକଗୁଡ଼ିକ ମଧ୍ୟରୁ ଡୁବେରିନର କେବଳ ତିନୋଟି ଟ୍ରାଇଏଡ୍ ଚିହ୍ନଟ କରିପାରିଥିଲେ ।
→ ଡୁବେରିନର ଶ୍ରେଣୀକରଣ ତୃଟି :
- ସବୁକ୍ଷେତ୍ରରେ ଏଭଳି ଟ୍ରାଇଏଡ୍ ବାଛିବା ସମ୍ଭବ ହେଲାନାହିଁ ।
- ଟ୍ରାଇଏଡ୍ର କିଛି ମୌଳିକରେ ବିଭିନ୍ନ ଧର୍ମ ଦେଖାଦେଲା । ତେଣୁ ଡୁବେରିନରଙ୍କ ଟ୍ରାଇଏଡ୍ ଶ୍ରେଣୀକରଣ ବ୍ୟବସ୍ଥାର ଉପାଦେୟତା ଦେଖାଗଲା ନାହିଁ।
- ଡୁବେରିନର ପ୍ରଥମେ ମୌଳିକଗୁଡ଼ିକର ଧର୍ମ ସହିତ ପାରମାଣବିକ ବସ୍ତୁତ୍ଵର ସମ୍ପର୍କ ସ୍ଥାପନ କରିଥିଲେ ।
→ ମିତଲାଶ୍ରକ ଅଷ୍ଟକ ନିୟମ (Newland’s Law of Octaves):
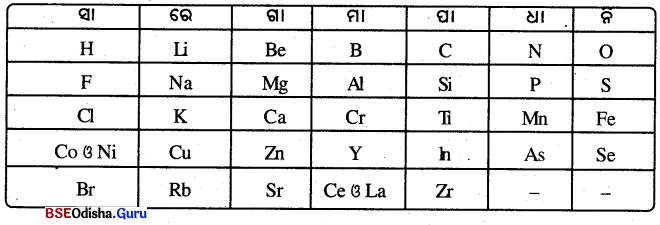
- 1866 ମସିହାରେ ଇଂଲଣ୍ଡ ରସାୟନବିତ୍ ଜନ୍ ନିଉଲାଣ୍ଡ ମୌଳିକର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵକୁ ଆଧାର କରି ଏକ ସମ୍ପୂର୍ଣ୍ଣ ସଜ୍ଜା ଦେବାକୁ ପ୍ରୟାସ କରି ଦର୍ଶାଇଥିଲେ ଯେ ମୌଳିକଗୁଡ଼ିକୁ ତାଙ୍କର ବର୍ଦ୍ଧିତ ପାରମାଣବିକ ବସ୍ତୁତ୍ୱ କ୍ରମରେ ସଜାଇଲେ ଏବଂ ପ୍ରତି ଅଷ୍ଟମ ମୌଳିକର ଧର୍ମ ପ୍ରଥମ ମୌଳିକର ଧର୍ମ ସହିତ ମେଳ ରହିବାର ଲକ୍ଷ୍ୟ କଲେ ।
- ଏହି ପର୍ଯ୍ୟବେକ୍ଷଣକୁ ନେଇ ମୌଳିକଗୁଡ଼ିକ ଶ୍ରେଣୀବିଭାଗ ପାଇଁ ସେ ତାଙ୍କ ଅଷ୍ଟକ ସୂତ୍ର ପ୍ରତିପାଦନ କରିଥିଲେ ।
ସେ ଏହାକୁ ସଙ୍ଗୀତର ଅଷ୍ଟକସ୍ଵର (ସାରେଗାମାପାଧାନିସା) ସହିତ ତୁଳନା କରି ଅଷ୍ଟକ ନିୟମ ଆଖ୍ୟା ଦେଇଥିଲେ । ତେଣୁ ଏହା ନିଉଲାଣ୍ଡଙ୍କ ଅଷ୍ଟକ ନିୟମ ରୂପେ ସୁପରିଚିତ । 
- ନିଉଲାଣ୍ଡ ସବୁଠାରୁ କମ୍ ପାରମାଣବିକ ବସ୍ତୁତ୍ୱ ହାଇଡ୍ରୋଜେନରୁ ଆରମ୍ଭ କରି56 ତମ ମୌଳିକ ଥୋରିୟମ୍ ଠାରେ ଶେଷ କରିଥିଲେ ।
→ ନିଉଲାଣ୍ଡଙ୍କ ଅଷ୍ଟକ ସମୂହ:
ସଙ୍ଗୀତର ସ୍ଵର:
→ ଛୁଟି :
- ନିଉଲାଣ୍ଡଙ୍କ ଅଷ୍ଟକ ନିୟମ କେବଳ କ୍ୟାଲସିୟମ୍ ପର୍ଯ୍ୟନ୍ତ ପ୍ରଯୁଜ୍ୟ । କ୍ୟାଲସିୟମ୍ ପରେ ଥିବା ପ୍ରତି ଅଷ୍ଟକ ମୌଳିକର ଧର୍ମ ପ୍ରଥମ ମୌଳିକର ଧର୍ମ ସହ ସମାନ ନ ଥିଲା ।
- ପରବର୍ତ୍ତୀ କାଳରେ ଆବିଷ୍କୃତ ହେବାକୁ ଥିବା ମୌଳିକମାନଙ୍କ ସକାଶେ କୌଣସି ବ୍ୟବସ୍ଥା ନଥିଲା ।
- ନିଉଲାଣ୍ଡଙ୍କ ଧାରଣା ଥିଲା ପ୍ରକୃତିରେ କେବଳ 56ଟି ମୌଳିକ ରହିଛି ଏବଂ ଭବିଷ୍ୟତରେ ଆଉ ଅଧ୍ଵକ ମୌଳିକ ଆବିଷ୍କୃତ ହେବନାହିଁ । କିନ୍ତୁ ପରବର୍ତୀ ସମୟରେ ଅନେକ ନୂଆ ମୌଳିକ ଆବିଷ୍କୃତ ହେଲା । ସେହି ଧର୍ମଗୁଡ଼ିକ ଅଷ୍ଟକ ନିୟମରେ ଖାପ ଖାଇଲାନାହିଁ ।
- କେତେକ କ୍ଷେତ୍ରରେ ମୌଳିକଗୁଡ଼ିକୁ ଖାପ ଖୁଆଇବା ପାଇଁ ଦୁଇଟି ମୌଳିକକୁ ଏକା ସ୍ଥାନରେ ରଖୁଥିଲେ ।
- ନିଉଲାଣ୍ଡ ଅସମଧର୍ମୀ ମୌଳିକମାନଙ୍କୁ ଏକ ସ୍ବରତଳେ ସ୍ଥାନିତ କରିଥିଲେ; ଯଥା— କୋବାଲଟ୍ ଓ ନିକେଲ ଏକା ସ୍ଥାନରେ ରହିଛି ଏବଂ ଫ୍ଲୋରିନ୍, କ୍ଲୋରିନ୍ ଓ ବ୍ରୋମିନ୍ ଥ୍ବା ସ୍ତମ୍ଭରେ ସ୍ଥାନିତ କରାଯାଇଛି । ଫ୍ଲୋରିନ୍, କ୍ଲୋରିନ୍ ଓ ବ୍ରୋମିନର ଧର୍ମ କୋବାଲଟ୍ ଓ ନିକେଲ୍ ଧର୍ମଠାରୁ ସଂପୂର୍ଣ୍ଣ ଭିନ୍ନ ଅଟେ ।
- ନିଉଲାଣ୍ଡ ସମଧର୍ମୀ ମୌଳିକଗୁଡ଼ିକୁ ଅଲଗା ସ୍ଥାନିତ କରିଥିଲେ; ଯଥା— ଆଇରନ୍ର ଧର୍ମ କୋବାଲଟ୍ ଓ ନିକେଲର ଧର୍ମରେ ସାମଞ୍ଜସ୍ୟ ଥିଲେ ମଧ୍ୟ ତାକୁ କୋବାଲଟ୍ ଓ ନିକେଲ୍ଠାରୁ ଅଲଗା ରଖାଯାଇଛି ।
ନିଉଲାଣ୍ଡଙ୍କ ଅଷ୍ଟକ ନିୟମ କେବଳ ହାଲୁକା ମୌଳିକଗୁଡ଼ିକ ପାଇଁ ଠିକ୍ କାର୍ଯ୍ୟ କଲା ।
![]()
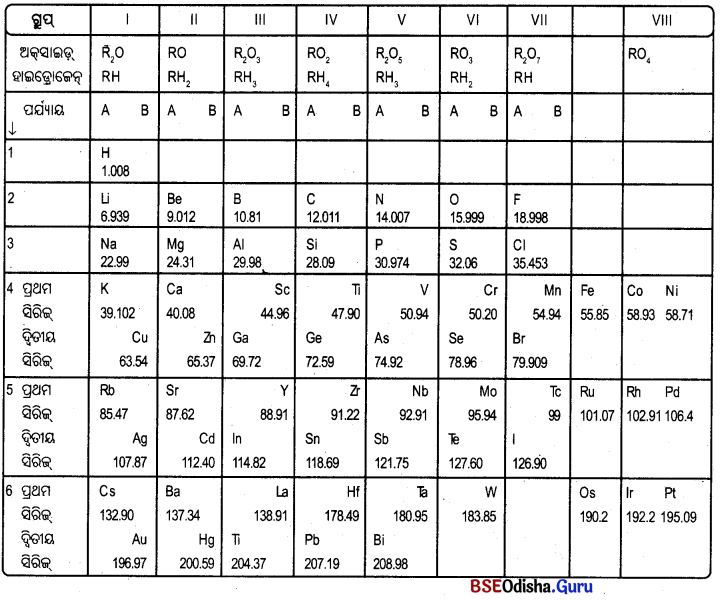
→ ମେଣ୍ଡେଲିଫ୍ଙ୍କ ପର୍ଯ୍ୟାୟ ସାରଣୀ (Mendeleev’s Periodic Table):

ଅବଦାନ ରହିଛି ।- ମେଣ୍ଡେଲିଫ୍ଙ୍କ ପର୍ଯ୍ୟାୟ ସାରଣୀ 1872 ମସିହାରେ ଜର୍ମାନୀର ଏକ ପତ୍ରିକାରେ ସ୍ଥାନ ପାଇଥିଲା ।
- ମେଣ୍ଡେଲିଫ୍ ପର୍ଯ୍ୟାୟ ସାରଣୀ ସମ୍ବନ୍ଧରେ କାର୍ଯ୍ୟ ଆରମ୍ଭ କଲାବେଳେ ମାତ୍ର 63ଟି ମୌଳିକ ଜଣାଥିଲା ।
→ ମେଣ୍ଡେଲିଫ୍ଙ୍କ ପର୍ଯ୍ୟାୟ ନିପମ
- ‘‘ମୌଳିକଗୁଡ଼ିକର ଗୁଣ ସେଗୁଡ଼ିକର ପାରମାଣବିକ ବସ୍ତୁତ୍ବର ପର୍ଯ୍ୟାୟ ଫଳନ’’ ।
- ଅର୍ଥାତ୍ ମୌଳିକଗୁଡ଼ିକୁ ସେଗୁଡ଼ିକର ପାରମାଣବିକ ବସ୍ତୁତ୍ଵର ବଦ୍ଧିତ କ୍ରମଅନୁସାରେ ସଜାଇଲେ, ମୌଳିକମାନଙ୍କର ଗୁଣସବୁ କ୍ରମାନ୍ୱୟରେ ବଦଳେ ଏବଂ କେତେକ ନିର୍ଦ୍ଦିଷ୍ଟ ସ୍ଥାନପରେ ଗୁଣଗୁଡ଼ିକର ପୁନରାବୃତ୍ତି ଘଟେ ।
- ମେଣ୍ଡେଲିଫ୍ଙ୍କ ପର୍ଯ୍ୟାୟ ସାରଣୀରେ ଥିବା ସ୍ତମ୍ଭକୁ ଗ୍ରୁପ୍ (Group) ଏବଂ ଧାଡ଼ିକୁ ପର୍ଯ୍ୟାୟ (Period) କୁହାଯାଏ ।
ଏଥିରେ ୫ଟି ଗ୍ରୁପ୍ ଓ 7ଟି ପର୍ଯ୍ୟାୟ ଅଛି । - ମେଣ୍ଡେଲିଫ୍ଙ୍କ ପର୍ଯ୍ୟାୟ ସାରଣୀର ପ୍ରତି ସ୍ତମ୍ଭ ଉପରେ ଅକ୍ସାଇଡ୍ ଓ ହାଇଡ୍ରାଇଡ୍ର ସଙ୍କେତରେ ଦିଆଯାଇଥିବା R ଅକ୍ଷର ସେହି ଗ୍ରୁପର ଯେକୌଣସି ମୌଳିକକୁ ସୂଚାଇବା ପାଇଁ ବ୍ୟବହାର କରାଯାଇଛି ।
→ ଉଦାହରଣ :
ନାଇଟ୍ରୋଜେନ ହାଇଡ୍ରାଇଡ୍ NH3 କୁ RH3 ରୂପେ ଏବଂ ମ୍ୟାଗ୍ନେସିୟମ ଅକ୍ସାଇଡ୍ MgO କୁ RO ରୂପେ ଲେଖାଯାଇଛି ।
ମେଣ୍ଡେଲିଫ୍ଙ୍କ ପର୍ଯ୍ୟାୟ ସାରଣୀ
→ ମେଣ୍ଡେଲିଫ୍ଙ୍କ ପର୍ଯ୍ୟାୟ ସାରଣୀରେ ସଫଳତା(Achievements of Mendeleev’s Periodic Table):
- ମେଣ୍ଡେଲିଫ୍ଙ୍କ ପର୍ଯ୍ୟାୟ ସାରଣୀରେ ପୂର୍ବପେକ୍ଷା ମୌଳିକଗୁଡ଼ିକୁ ଅଧିକ ଠିକ୍ଭାବରେ ସଜ୍ଜା ଯାଇଥିଲା
- ସାମାନ୍ୟ ଅଧ୍ବକ ପାରମାଣବିକ ବସ୍ତୁତ୍ଵର ମୌଳିକକୁ ଏହାଠାରୁ କମ୍ ପାରମାଣବିକ ବସ୍ତୁତ୍ଵର ମୌଳିକ ପୂର୍ବରୁ ସ୍ଥାନିତ କରିଥିଲେ ।
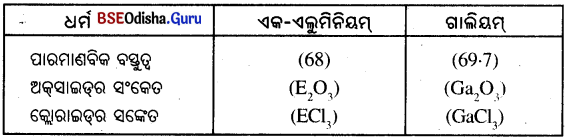
ଉଦାହରଣସ୍ୱରୂପ କୋବାଲ୍ଟ (ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ 58.9) ନିକେଲ ପାରମାଣବିକ ବସ୍ତୁତ୍ୱ 58.7 ) ପୂର୍ବରୁ ରହିଛି । ଫଳରେ ଅନୁକ୍ରମ (Sequence) ଅଦଳ ବଦଳ କରିବା ଫଳରେ ସମଧର୍ମୀ ମୌଳିକଗୁଡ଼ିକ ଏକତ୍ର ଶ୍ରେଣୀବଦ୍ଧ ହୋଇପାରିଲା । - ମେଣ୍ଡେଲିଫ୍ ତାଙ୍କ ପର୍ଯ୍ୟାୟ ସାରଣୀରେ କେତେଗୁଡ଼ିଏ ଖାଲି ସ୍ଥାନ ରଖୁଥିଲେ । ଫଳରେ ପରେ ଆବିଷ୍କୃତ ହୋଇଥିବା ମୌଳିକଗୁଡ଼ିକ ଓ ନୋବେଲ୍ ଗ୍ୟାସଗୁଡ଼ିକ ପର୍ଯ୍ୟାୟ ସାରଣୀର ବ୍ୟବସ୍ଥାକୁ ଅଦଳ ବଦଳ ନ କରି ସୁବିଧାରେ ସ୍ଥାନିତ କରାଗଲା । ମେଣ୍ଡେଲିଫ୍ ସେହି ମୌଳିକଗୁଡ଼ିକୁ ସେହି ଗ୍ରୁପର ପୂର୍ବବର୍ତୀ ମୌଳିକ ନାମ ପୂର୍ବରୁ ସଂସ୍କୃତ ଶବ୍ଦ ‘ଏକ’ (Eka) ଯୋଗକରି ନାମିତ କରିଥିଲେ । ଉଦାହରଣସ୍ୱରୂପ, ସ୍କାଣ୍ଡିୟମ, ଗାଲିୟମ୍ ଓ ଜର୍ମାନିୟମର ଧର୍ମ ଯଥାକ୍ରମେ ଏକ-ବୋରନ୍ ଏକ-ଏଲୁମିନିୟମ୍, ଏକ-ସିଲିକନର ଧର୍ମସହିତ ସମାନ ।
ଏକ-ଏଲୁମିନିୟମ୍ ଏବଂ ଗାଲିୟମ୍ର ଧର୍ମ
- ହିଲିୟମ୍ (He), ନିୟମ (Ne) ଏବଂ ଆର୍ଶନ (Ar) ପରି ନୋବେଲ ଗ୍ୟାସ୍ଗୁଡ଼ିକ ବହୁତ ବିଳମ୍ବରେ ଆବିଷ୍କୃତ ହେଲା । ପର୍ଯ୍ୟାୟ ସାରଣୀରେ ରହିଥିବା ବ୍ୟବସ୍ଥାକୁ ଅଦଳ ବଦଳ ନ କରି, ଏହି ଗ୍ୟାସ୍ଗୁଡ଼ିକ ଆବିଷ୍କୃତ ହେଲା ପରେ ସେଗୁଡ଼ିକୁ ଏକ ନୂଆ ଗ୍ରୁପ୍ରେ ସ୍ଥାନିତ କରାଯାଇ ପାରିଲା ।
→ ମେଣ୍ଡେଲଫ୍ ଙ୍କ ଶ୍ରେଣ1କରଣର ତୃଟି (Limitations of Mendeleev’s Classification):
(i) ହାଇଡ୍ରୋଜେନ୍ର ଇଲେକ୍ଟ୍ରନ୍ ସଂରଚନା କ୍ଷାରୀୟ ଧାତୁ (Li, Na, K) ଗୁଡ଼ିକର ଇଲେକ୍ଟ୍ରନ୍ ସଂରଚନା
![]()
→ ଉଦାହରଣ:
Hର ଇଲେକ୍ଟ୍ରନ୍ ସଂରଚନା = 1 (K)
Liର ଇଲେକ୍ଟ୍ରନ୍ ସଂରଚନା = 2(K), 1(L)
Naର ଇଲେକ୍ଟ୍ରନ୍ ସଂରଚନା = 2(K), 8(L), 1(M)
Kର ଇଲେକ୍ଟ୍ରନ୍ ସଂରଚନା = 2(K), 8(L), 8(M), 1(N)
ପୁନଶ୍ଚ ହାଇଡ୍ରୋଜେନ୍, କ୍ଷାରୀୟ ଧାତୁଗୁଡ଼ିକ ପରି ହାଲୋଜେନ୍ (F, CI, Br) ଅକ୍ସିଜେନ୍ ଓ ସଲ୍ଫର ସହିତ ସଂଯୁକ୍ତ ହୋଇ ଏକାଭଳି ସଂକେତର ଯୌଗିକମାନ ସୃଷ୍ଟି କରେ । ନିମ୍ନ ସାରଣୀକୁ ଅନୁଧ୍ୟାନ କର ।
ହାଇଡ୍ରୋଜେନ୍ର ଯୌଗିକ
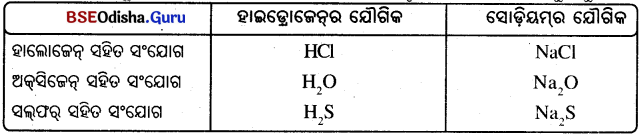
ସୁତରାଂ ହାଇଡ୍ରୋଜେନ୍କୁ ପର୍ଯ୍ୟାୟ ସାରଣୀରେ ଏକ ନିର୍ଦ୍ଦିଷ୍ଟ ସ୍ଥାନ ଦିଆଯାଇ ପାରିବ ନାହିଁ ।
(ii)
ଆଇସୋଟୋପ୍ ହେଉଛି ସମାନ ପରମାଣୁ କ୍ରମାଙ୍କ ବିଶିଷ୍ଟ ମୌଳିକର ଭିନ୍ନ ପାରମାଣବିକ ବସ୍ତୁତ୍ଵର ପରମାଣୁ ସମୂହ । ତେଣୁ ମେଣ୍ଡେଲିଫ୍ଙ୍କ ଶ୍ରେଣୀକରଣ ନିୟମ ଅନୁଯାୟୀ ଆଇସୋଟୋପ୍ଗୁଡ଼ିକ ଭିନ୍ନ ଭିନ୍ନ ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ ହେତୁ ଭିନ୍ନ ଭିନ୍ନ ସ୍ଥାନରେ ରଖୁବା ଆବଶ୍ୟକ ।
ଉଦାହରଣସ୍ୱରୂପ, 1, 2 ଓ 3 ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ ବିଶିଷ୍ଟ ହାଇଡ୍ରୋଜେନ୍ର ଆଇସୋଟୋପ୍ଗୁଡ଼ିକୁ ତିନୋଟି ସ୍ଥାନରେ ରଖୁବା ଉଚିତ; କିନ୍ତୁ ମେଣ୍ଡେଲିଫ୍ଙ୍କ ପର୍ଯ୍ୟାୟ ସାରଣୀରେ ସମାନ ରାସାୟନିକ ଧର୍ମବିଶିଷ୍ଟ ହାଇଡ୍ରୋଜେନ୍ର ଆଇସୋଟୋପ୍ଗୁଡ଼ିକୁ ପୃଥକ୍ ସ୍ଥାନ ଦିଆଯାଇ ନ ଥିଲା ।
(iii) କେତେକ କ୍ଷେତ୍ରରେ ମେଣ୍ଡେଲିଫ୍ ପାରମାଣବିକ ବସ୍ତୁତ୍ଵର ବର୍ଦ୍ଧିତ କ୍ରମକୁ ଭିଭି ନ କରି ସମାନ ଧର୍ମ ଅନୁଯାୟୀ ମୌଳିକାଟୁଡିକର ସ୍ଥାନ ଦେଇଥିଲେ |
ଉଦାହରଣସ୍ୱରୂପ, 39.9 ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ ବିଶିଷ୍ଟ ଆର୍ଗନ୍ (Ar)କୁ 39.1 ପାରମାଣବିକ ବସ୍ତୁତ୍ଵ ବିଶିଷ୍ଟ ପୋଟାସିୟମ୍ (K) ପୂର୍ବରୁ ରଖାଯାଇଥିଲା । ଏଭଳି ଉପସ୍ଥାପନ ଯୁକ୍ତିସିଦ୍ଧ ନ ଥିଲା ।
(iv) ମେଣ୍ଡେଲିଫ୍ଙ୍କ ପର୍ଯ୍ୟାୟ ସାରଣୀରେ କେତେକ ସହଧର୍ମୀ ମୌଳିକଗୁଡ଼ିକୁ ଭିନ୍ନ ଗ୍ରୁପ୍ରେ ରଖାଯାଇଥିବା ବେଳେ ଅସମ ଧର୍ମୀ ମୌଳିକଗୁଡ଼ିକୁ ଏକତ୍ର ରଖାଯାଇଥିଲା ।
ଉଦାହରଣସ୍ୱରୂପ, କପରର ଧର୍ମ, ପାରଦର ଧର୍ମ ସହିତ ସାମଞ୍ଜସ୍ୟ ଥିଲେ ମଧ୍ୟ ସେମାନଙ୍କୁ ଭିନ୍ନ ଶ୍ରେଣୀରେ ରଖାଯାଇଥିଲା । ଅନ୍ୟପକ୍ଷରେ Li, Na ଓ K ଆଦି ମୌଳିକର ଧର୍ମ Cu, Ag ଓ Au ଆଦି ମୌଳିକର ଧର୍ମଠାରୁ ଯଥେଷ୍ଟ ଭିନ୍ନ ଥିଲେ ମଧ୍ୟ ସେଗୁଡ଼ିକୁ ଏକତ୍ର ରଖାଯାଇଥିଲା ।
(v) ମେଣ୍ଡେଲିଫ୍ ମୌଳିକଗୁଡ଼ିକ ମଧ୍ୟରେ ପର୍ଯ୍ୟାୟତା (Periodicity) ର କାରଣ ବୁଝାଇପାରି ନ ଥିଲେ ।
→ ଆଧୁନିକ ପର୍ଯ୍ୟାୟ ସାରଣୀ (The Modern Periodic Table):
ହେନ୍ରୀ ମୋସଲୀ 1913 ମସିହାରେ ଦର୍ଶାଇଥିଲେ ଯେ ଗୋଟିଏ ମୌଳିକର ପରମାଣୁ କ୍ରମାଙ୍କ ଏହାର ପାରମାଣବିକ ବସ୍ତୁତ୍ୱଠାରୁ ଅଧିକ ଗ୍ରହଣୀୟ ବା ଅଧିକ ପ୍ରାଥମିକ ଧର୍ମ ଅଟେ । ପରମାଣୁ କ୍ରମାଙ୍କକୁ ଆଧୁନିକ ପର୍ଯ୍ୟାୟ ସାରଣୀର ମୂଳସୂତ୍ର ରୂପେ ଗ୍ରହଣ କରାଗଲେ, ଆଧୁନିକ ପର୍ଯ୍ୟାୟ ନିୟମଟି ହେଲା-
‘ମୌଳିକଗୁଡ଼ିକର ଗୁଣ, ସେଗୁଡ଼ିକର ପରମାଣୁ କ୍ରମାଙ୍କର ପର୍ଯ୍ୟାୟ ଫଳନ’’।
ବ୍ୟାଖ୍ୟା:
ମୌଳିକଗୁଡ଼ିକୁ ପରମାଣୁ କ୍ରମାଙ୍କର ବଦ୍ଧିତ କ୍ରମଭିତ୍ତିରେ ସଜାଗଲେ ସେଗୁଡ଼ିକର ଗୁଣ ପରମାଣୁ କ୍ରମାଙ୍କ ଅନୁସାରେ ପରିବର୍ତ୍ତନ ହୁଏ ଏବଂ ସାମଞ୍ଜସ୍ୟ ଗୁଣଥୁବା ମୌଳିକମାନେ ଏକ ଗ୍ରୁପରେ ରହିଥାଆନ୍ତି ।
![]()
→ ଆଧୁନିକ ପର୍ଯ୍ୟାୟ ସାରଣୀରେ ମୌଳିକଗୁଡ଼ିକର ସ୍ଥାନ (Position of Elements in the Modern Periodic Table):
ଦ୍ୱିତୀୟ ପର୍ଯ୍ୟାୟରେ ଥିବା ମୌଳିକଗୁଡ଼ିକର ଇଲେକ୍ଟ୍ରନ୍ ସଂରଚନା:
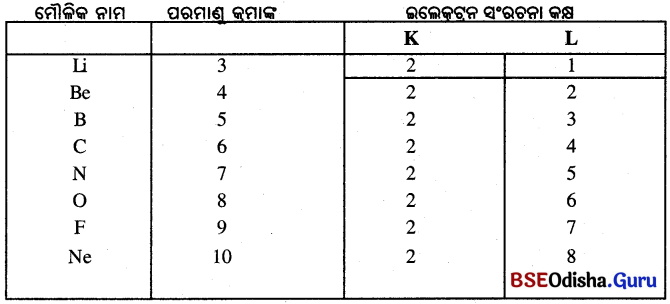
- ଏହି ପର୍ଯ୍ୟାୟରେ ଥିବା ମୌଳିକଗୁଡ଼ିକର ପରମାଣୁରେ ସମାନ ସଂଖ୍ୟକ ସଂଯୋଜକ ଇଲେକ୍ଟ୍ରନ ନାହିଁ କିନ୍ତୁ ସମାନ ସଂଖ୍ୟକ କକ୍ଷ ଅଛି ।
- ସମାନ ସଂଖ୍ୟକ କକ୍ଷ ରହିଥିବା ପରମାଣୁଗୁଡ଼ିକର ବିଭିନ୍ନ ମୌଳିକକୁ ଏକା ପର୍ଯ୍ୟାୟରେ ସ୍ଥାନିତ କରାଯାଇଛି । ପର୍ଯ୍ୟାୟ ବଢ଼ିଲେ କକ୍ଷ ସଂଖ୍ୟା ବଢ଼େ ।
- ସଂଯୋଜକ ଇଲେକ୍ଟ୍ରନ ଦ୍ବାରା ମୌଳିକ କେଉଁ ପ୍ରକାରର ବନ୍ଧ ଗଠନ କରିବ ତାହା ଜଣାଯାଏ ।
- କୌଣସି ମୌଳିକର ଅବସ୍ଥିତିରୁ ଏହାର ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାଶୀଳତା (Chemical reactivity)
→ ଜଣାପଡ଼େ । ଏ ଧୁନିକ ପର୍ଯ୍ୟାୟ ସାରଣୀରେ ମୌଳିକଗୁଡ଼ିକର ଗୁଣରେ କ୍ରମିକ ପରିବର୍ତ୍ତନ (Trends in the Modern Periodic Table):
ଯୋଗ୍ୟତା:
ଗୋଟିଏ ମୌଳିକର ଯୋଗ୍ଯତା ଏହାର ବାହ୍ୟତମ କକ୍ଷରେ ଥିବା ସଂଯୋଜକ ଇଲେକ୍ଟ୍ରନ ଦ୍ୱାରା ନିରୂପଣ କରାଯାଏ ।
→ ଧାତବ ଓ ଅଧାତବ ଶ୍ରଣ (Metallic and Non – metallic Properties):
