Odisha State Board BSE Odisha 10th Class Physical Science Notes Chapter 1 ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ଓ ରାସାୟନିକ ସମୀକରଣ will enable students to study smartly.
BSE Odisha Class 10 Physical Science Notes Chapter 1 ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ଓ ରାସାୟନିକ ସମୀକରଣ
→ ଉପକ୍ରମ (Introduction) :
- ଦୈନନ୍ଦିନ ଜୀବନରେ କେତେଗୁଡ଼ିଏ ଘଟଣା ଘଟିଥାଏ, ଯେଉଁଥରେ ମୂଳପଦାର୍ଥର ପ୍ରକୃତି ଓ ନିଜସ୍ଵ ସଭାରେ କିଛି ହେଲେ ପରିବର୍ତ୍ତନ ଘଟିଥାଏ । ଆମ ଚତୁଃପାର୍ଶ୍ଵରେ ଘଟୁଥିବା ଏହି ପରିବର୍ତ୍ତନଗୁଡ଼ିକର କେତେକ ଉଦାହରଣ ନିମ୍ନରେ ପ୍ରଦାନ କରାଗଲା ।
- ଖରାଦିନେ କ୍ଷୀରକୁ ସାଧାରଣ ତାପମାତ୍ରାରେ ରଦେଲେ, ତାହା ଛିଣ୍ଡିଯାଇ ଛେନାରେ ପରିଣତ ହୋଇଥାଏ ।
- ଲୁହା ନିର୍ମିତ ପଦାର୍ଥ ଆର୍ଦ୍ର ବାୟୁରେ ପଡ଼ି ରହିଲେ କଳଙ୍କି ଲାଗିଯାଏ; ଫଳରେ ପଦାର୍ଥର କ୍ଷୟ ଘଟିଥାଏ । ଅଙ୍ଗୁର ଅତ୍ମକ ଦିନ ଘରେ ରହିଲେ ପଚିଯାଏ ।
- ଆମେ ଖାଉଥିବା ଖାଦ୍ୟ ପାକସ୍ଥଳୀରେ ହଜମ ହୋଇ ସରଳ ଖାଦ୍ୟସାରରେ ପରିଣତ ହୋଇଥାଏ ।
- ଶ୍ଵାସକ୍ରିୟା ବେଳେ ଆମେ ପ୍ରଶ୍ଵାସରେ ଅମ୍ଳଜାନ ଗ୍ରହଣ କରୁ ଓ ନିଃଶ୍ଵାସରେ ଅଙ୍ଗାରକାମ୍ଳ ଗ୍ୟାସ୍ ତ୍ୟାଗ କରୁ । ଏ କ୍ଷେତ୍ରରେ ମୂଳ ପଦାର୍ଥର ପ୍ରକୃତି ଓ ନିଜସ୍ଵ ସତ୍ତାର ପରିବର୍ତ୍ତନ ଘଟିଥାଏ ।
- ଏଥୁରୁ ସ୍ପଷ୍ଟ ଅନୁମେୟ ଯେ, ପଦାର୍ଥର ପ୍ରକୃତି ନିଜସ୍ଵ ସଭାର କୌଣସି ନା କୌଣସି ସମୟରେ କିଛି କିଛି ପରିବର୍ତ୍ତନ ଘଟିଥାଏ ।
- ପରିବର୍ତ୍ତନଗୁଡ଼ିକୁ ମଧ୍ୟରୁ କେତେକଙ୍କର ସ୍ଥାୟୀ ପରିବର୍ତ୍ତନ ଓ ଅନ୍ୟ କେତେକଙ୍କର ଅସ୍ଥାୟୀ ପରିବର୍ତ୍ତନ ହୋଇଥାଏ ।
- ପୂର୍ବ ଶ୍ରେଣୀରେ ବସ୍ତୁର ସ୍ଥାୟୀ ପରିବର୍ତ୍ତନ ଓ ଅସ୍ଥାୟୀ ପରିବର୍ତ୍ତନ ଅର୍ଥାତ୍ ରାସାୟନିକ ଏବଂ ଭୌତିକ ପରିବର୍ତ୍ତନ ବିଷୟରେ ଅବଗତ । ଏହି ଅଧ୍ୟାୟରେ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ଏବଂ ଏହାର ଲିଖନ ପ୍ରକ୍ରିୟା ସହିତ କେତେକ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ବିଷୟରେ ଅବଗତ ହେବା ।
- ଏହି ସ୍ଥାୟୀ ଓ ଅସ୍ଥାୟୀ ପରିବର୍ତ୍ତନକୁ ଭୌତିକ ପରିବର୍ତ୍ତନ ଓ ରାସାୟନିକ ପରିବର୍ତ୍ତନ କହନ୍ତି । ରାସାୟନିକ ପରିବର୍ତ୍ତନ ଘଟିଲେ ଏକ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ଘଟିଥାଏ ।
→ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା (Chemical Reaction) :
- ରାସାୟନିକ ପରିବର୍ତ୍ତନ ଘଟିଲେ ତା’କୁ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା କୁହାଯାଏ ।
ଯେଉଁ ପ୍ରତିକ୍ରିୟାରେ ଭିନ୍ନ ଧର୍ମ ବିଶିଷ୍ଟ ନୂତନ ପଦାର୍ଥ ସୃଷ୍ଟି ହୁଏ । ତାହାକୁ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା କୁହାଯାଏ - ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ଭାଗ ନେଉଥିବା ପଦାର୍ଥକୁ ପ୍ରତିକାରକ କୁହାଯାଏ ଓ ଏହା ଯୋଗୁଁ ସୃଷ୍ଟି ହେଉଥିବା ପଦାର୍ଥକୁ ଉତ୍ପାଦ କୁହାଯାଏ ।
- ଉଦାହରଣ : ଜିଙ୍କ ଧାତୁ ଲଘୁ ଗନ୍ଧକାମ୍ଳ ଅମ୍ଳ ସହ ପ୍ରତିକ୍ରିୟା ଘଟି ଜିଙ୍କ୍ ସଲଫେଟ୍ ଓ ଉଦ୍ଜାନ ଗ୍ୟାସ ସୃଷ୍ଟି ହୁଏ । ଏଠାରେ ଜିଙ୍କ୍ ଓ ଗନ୍ଧକାମ୍ଳ ପ୍ରତିକାରକ ହୋଇଥିବାବେଳେ ଜିଙ୍କ୍ ସଲଫେଟ୍ ଓ ଉଦ୍ଜାନ ଗ୍ୟାସ ଉତ୍ପାଦ ଅଟନ୍ତି । ନିମ୍ନଲିଖତ ପରୀକ୍ଷଣରୁ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା କିପରି ଘଟେ ଆସ ଜାଣିବା :
→ ରାସାୟନିକ ପରିବର୍ତ୍ତନ (Chemical change) :
ଆମ ଚତୁଃପାର୍ଶ୍ଵରେ ଘଟୁଥିବା ବିଭିନ୍ନ ପ୍ରକାର ରାସାୟନିକ ପରିବର୍ତ୍ତନକୁ ଲକ୍ଷ୍ୟ କଲେ ଜଣାଯାଏ ଯେ, ଏ ମସ୍ତ କ୍ଷେତ୍ରରେ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ଘଟି ନୂତନ ପଦାର୍ଥମାନ ସୃଷ୍ଟି ହୋଇଥାଏ । ନିମ୍ନଲିଖ ପର୍ଯ୍ୟବେକ୍ଷଣ ସାହାଯ୍ୟରେ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ନିମ୍ନ ପରିବର୍ତ୍ତନଗୁଡ଼ିକ ସାଧାରଣତଃ ଘଟିଥାଏ । ସେଗୁଡ଼ିକ ହେଲା! –
(a) ଅବସ୍ଥାରେ ପରିବର୍ତ୍ତନ (Change of State)
(b) ରଇଂର ପରିବର୍ତ୍ତନ (Change of Colour)
(c) ଖ୍ୟାସ୍ର ନିର୍ଗମନ (Evolution of gas)
(d) ତାପମାତ୍ରାର ପରିବର୍ତ୍ତନ (Change of temperature)
(e) ଅବକ୍ଷେପ ସୃଷ୍ଟି (Formation of Precipitate)
![]()
ଉଦାହରଣ :
କାଠ ଜଳି ଧୂଆଁ ଓ ପାଉଁଶ ହେବା, ଲୁହାରେ କଳଙ୍କି ଲାଗିବା, କ୍ଷୀର ଦହିରେ ପରିଣତ ହେବା । ଏଗୁଡ଼ିକ ରାସାୟନିକ ପରିବର୍ତ୍ତନ ।
→ ରାସାୟନିକ ସମୀକରଣ (Chemical Equations) :
- ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାକୁ ଡ୍ପସ୍ଥାପନ କରିବା ପାଇଁ ବ୍ୟବହୃତ ଭକ୍ତିକ୍ତ ରାସାୟନିକ ସମ1ଜଗଣ କହନ୍ତି
ରାସାୟନିକ ସମୀକରଣଦ୍ବାରା ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାଟି ଅର୍ଥହୀନ ହୋଇଥାଏ । - ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାକୁ ବାକ୍ୟରେ ଲେଖୁଲେ ଏହା ଦୀର୍ଘ ହୋଇଥାଏ । ତେଣୁ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାକୁ କ୍ଷୁଦ୍ର ଓ ସଂକ୍ଷିପ୍ତ ରୂପରେ ଲେଖୁ ପାଇଁ ଶବ୍ଦ-ସମୀକରଣ ବ୍ୟବହାର କରାଯାଏ ।
- ମ୍ୟାଗ୍ନେସିୟମ୍ ପାତକୁ ଅକ୍ସିଜେନ୍ ଉପସ୍ଥିତିରେ ଜାଳିଲେ ତାହା ମ୍ୟାଗ୍ନେସିୟମ୍ ଅକ୍ସାଇଡ୍ରେ ପରିଣତ ହୁଏ
- ମ୍ୟାଗ୍ନେସିୟମ୍ ଓ ଅକ୍ସିଜେନ୍ର ଦହନ ପ୍ରତିକ୍ରିୟାର ଶବ୍ଦ-ସମୀକରଣଟି ହେବ :

- ଏ କ୍ଷେତ୍ରରେ ମ୍ୟାଗ୍ନେସିୟମ୍ ଓ ଅକ୍ସିଜେନ୍ ମଧ୍ଯରେ ରାସାୟନିକ ପରିବର୍ତ୍ତନ ଘଟୁଥିବାରୁ ଏହାକୁ ପ୍ରତିକାରକ (Reactants) କୁହାଯାଏ । ମ୍ୟାଗ୍ନେସିୟମ୍ ଅକ୍ସାଇଡ୍ ନୂତନ ପଦାର୍ଥରୂପେ ଉତ୍ପନ୍ନ ହେଉଥିବାରୁ ତାହାକୁ ଉତ୍ପାଦ (Product) କୁହାଯାଏ ।
→ ଶବ୍ଦ-ସମୀକରଣ ଲେଖାର| ନିୟମ (Rules of Writing Word Equation) :
- ଶବ୍ଦ-ସମୀକରଣରେ ପ୍ରତିକାରକଗୁଡ଼ିକୁ ବାମପାର୍ଶ୍ବରେ (L.H.S.) ଓ ଉତ୍ପାଦଗୁଡ଼ିକୁ ଦକ୍ଷିଣପାର୍ଶ୍ବରେ (R.H.S.) ଲେଖାଯାଏ ।
- ପ୍ରତିକାରକ ଓ ଉତ୍ପାଦ ମଧ୍ଯରେ ଏକ ତୀର (→) ଚିହ୍ନ ଦିଆଯାଏ । ତୀରଟି ବାମରୁ ଦକ୍ଷିଣକୁ ହୋଇଥା ଏବଂ ଏହା ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାର ଦିଗ ନିର୍ଦ୍ଦେଶ କରିଥାଏ।
- ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ଏକାଧିକ ପ୍ରତିକାରକ ଓ ଏକାଧିକ ଉତ୍ପାଦ ଥିଲେ ସେଗୁଡ଼ିକ ମଧ୍ୟରେ ଯୁକ୍ତ (+) ଚିହ୍ନ ଦିଆଯାଇଥାଏ ।
→ ରାସାୟନିକ ସମୀକରଣ ଲେଖୁବା ପ୍ରଣାଳୀ (Writing a Chemical Equation) :
- ‘ଶବ୍ଦ ବଦଳରେ ପ୍ରତିକାରକ ଓ ଉତ୍ପାଦଗୁଡ଼ିକର ରାସାୟନିକ ସଂକେତ ବ୍ୟବହାର କରି ରାସାୟନିକ ସମୀକରଣକୁ ଲେଖୁ ସମୀକରଣଟି ଅଧ୍ଵ ସଂକ୍ଷିପ୍ତ, ତଥ୍ୟପୂର୍ଣ୍ଣ ଓ ବ୍ୟବହାର ଯୋଗ୍ୟ ହୋଇପାରିବ ।
- ଏକ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାକୁ ରାସାୟନିକ ସମୀକରଣ ଦ୍ଵାରା ପ୍ରକାଶ କରାଯାଏ ।
- ବାମ ପାର୍ଶ୍ବ (ପ୍ରତିକାରକ ପାର୍ଶ୍ଵ) ଓ ଦକ୍ଷିଣ ପାର୍ଶ୍ଵ (ଉତ୍ପାଦ ପାର୍ଶ୍ୱ) ର ପ୍ରତ୍ୟେକ ମୌଳିକର ପରମାଣୁ ସଂଖ୍ୟା ଉଭୟ ପାର୍ଶ୍ଵରେ ସମାନ ନ ରହିଲେ ଏହାକୁ ଅସମତୁଲ ସମୀକରଣ (Unbalanced equation) କୁହାଯାଏ । ଏହାର ଉଭୟ ପାର୍ଶ୍ଵର ବସ୍ତୁତ୍ଵ ସମାନ ନ ଥାଏ ।
- ଅସମତୁଲ ସମୀକରଣ କେବଳ ପ୍ରତିକାରକ ଓ ଉତ୍ପାଦର ସୂଚନା ଦେଉଥିବାରୁ ଏହାକୁ ସୂଚକୀୟ ରାସାୟନିକ ସମୀକରଣ (Skeletal Chemical equation) କରାଯାଏ |
ଉଦାହରଣ :
ବାୟୁ ଉପସ୍ଥିତିରେ ମ୍ୟାଗ୍ନେସିୟମ୍ ପାତର ଦହନ ପ୍ରତିକ୍ରିୟାର ସୂଚକୀୟବ ଅସମତୁଲ ରାସାୟନିକ ସମୀକରଣଟି ହେବ :
Mg + 02 → MgO

→ ସମତୁଲ ରାସାୟନିକ ସମ1ଜଟଣ (Balanced Chemical Equations) :
- ବସ୍ତୁତ୍ଵ ସଂରକ୍ଷଣ ନିୟମ (Law of conservation of mass) ଅନୁସାରେ, କୌଣସି ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ବସ୍ତୁତ୍ଵର ସୃଷ୍ଟି କିମ୍ବା ବିନାଶ ଘଟେ ନାହିଁ । ଅର୍ଥାତ୍ କୌଣସି ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ଉତ୍ପାଦରେ ଥୁବା ମୌଳିକଗୁଡ଼ିକର ମୋଟ ବସ୍ତୁତ୍ଵ ପ୍ରତିକାରକରେ ଥିବା ମୌଳିକ ଗୁଡ଼ିକର ମୋଟ ବସ୍ତୁତ୍ଵ ସହିତ ନିଶ୍ଚୟ ସମାନ ରହିବ ।
- ଅନ୍ୟ ପ୍ରକାରରେ କହିଲେ, ପ୍ରତ୍ୟେକ ମୌଳିକର ପରମାଣୁଗୁଡ଼ିକର ସଂଖ୍ୟା, ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ପୂର୍ବରୁ ଓ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ପରେ ସମାନ ରହିବ।
- ତେଣୁ ଆମକୁ ସୂଚକୀୟ ରାସାୟନିକ ସମୀକରଣ (Skeletal Chemical equation)କୁ ସମତୁଲ ରାସାୟନିକ ସମୀକରଣରେ ପରିଣତ କରିବାକୁ ପଡ଼ିବ ।
- ଯେଉଁ ରାସାୟନିକ ସମୀକରଣର ଉଭୟ ପାର୍ଶ୍ଵରେ ପ୍ରତ୍ୟେକ ମୌଳିକର ପରମାଣୁ ସଂଖ୍ୟା ସମାନ ରହିଥାଏ, ତାକୁ ସମତୁଲ ରାସାୟନିକ ସମୀକରଣ କୁହାଯାଏ ।
![]()
→ ରାସାୟନିକ ସମୀକରଣକୁ ସମତୁଲ କରିବା ପ୍ରଣାଳୀ :
- ଜିଙ୍ଗ୍ ସହିତ ସଲଫ୍ୟୁରିକ ଏସିଡ୍ର ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରୁ ଜିଙ୍କ୍ ସଲଫେଟ୍ ଏବଂ ହାଇଡ୍ରୋଜେନ ଗ୍ୟାସ୍ ସୃଷ୍ଟି ହୋଇଥାଏ । ଏହି ପ୍ରତିକ୍ରିୟାର ଶବ୍ଦ-ସମୀକରଣଟି ହେବ :
- ଜିଙ୍କ୍ + ସଲଫ୍ୟୁରିକ୍ ଏସିଡ୍ → ଜିଙ୍କ୍ ସଲଫେଟ୍ + ହାଇଡ୍ରୋଜେନ୍ ଗ୍ୟାସ୍
Zn + H2SO4 → ZnSO4 + H2 ↑ - ବର୍ତ୍ତମାନ ତୀର ଚିହ୍ନର ଉଭୟ ପାର୍ଶ୍ଵରେ ଥିବା ପ୍ରତ୍ୟେକ ମୌଳିକର ପରମାଣୁ ସଂଖ୍ୟା କଳନା କରି ନିମ୍ନରେ ଏକ ସାରଣୀ ପ୍ରସ୍ତୁତ କରାଗଲା ।
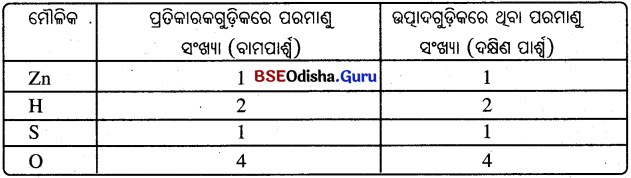
- ଏହି ସାରଣୀକୁ ଲକ୍ଷ୍ୟକଲେ ଜଣାଯାଏ ଯେ, ତୀର ଚିହ୍ନର ଉଭୟ ପାର୍ଶ୍ଵରେ ପ୍ରତ୍ୟେକ ମୌଳିକର ପରମାଣୁ ଗୁଡ଼ିକର ସଂଖ୍ୟା ସମାନ ଅଛି । ତେଣୁ ଏହା ଏକ ସମତୁଲ ରାସାୟନିକ ସମୀକରଣ ଅଟେ ।
→ ଅସମତୁଲ ରାସାୟନିକ ସମୀକରଣକୁ ସମତୁଲ କରିବା ପ୍ରଣାଳୀ :
ପରଗ ନିରେଖ ପଦ୍ଧତି :
ଉତ୍ତପ୍ତ ଲୁହା ଉପରେ ଜଳୀୟବାଷ୍ପ ପ୍ରବାହିତ କଲେ ଲୌହ ଅକ୍ସାଇଡ୍ ଓ ହାଇଡ୍ରୋଜେନ୍ ଗ୍ୟାସ୍ ସୃଷ୍ଟି ହୁଏ ଏହି ପ୍ରତିକ୍ରିୟାରେ ଶବ୍ଦ ସମୀକରଣଟି ହେବ :
ଲୁହା ଜଳ1ପ୍ରଚାଷ୍ଟ → ଲୌହ ଅକ୍ସାଇଡ୍ + ହାଇଡ୍ରୋଜେନ ଗ୍ୟାସ୍
ଏହି ଶବ୍ଦ-ସମୀକରଣକୁ ପ୍ରତୀକ ଓ ସଂକେତ ବ୍ୟବହାର କରି ଲେଖୁଲେ ହେବ :
Fe + H2O → Fe3O4 + H2
ସୋପାନ – 1 :
ଏହି ରାସାୟନିକ ସମୀକରଣକୁ ସମତୁଲ କରିବାପାଇଁ ପ୍ରଥମେ ପ୍ରତ୍ୟେକ ସଂକେତର ଚତୁଃପାର୍ଶ୍ଵରେ ବାକ୍ସ ଅଙ୍କନ କରାଯାଉ । ସମତୁଲ କରିବା ସମୟରେ ବାକ୍ସ ମଧ୍ୟସ୍ଥ ଉପାଦାନଗୁଡ଼ିକର କୌଣସି ପରିବର୍ତ୍ତନ କରିବା ନାହିଁ ।
![]()
ସୋପାନ – 2 :
ପ୍ରତିକାରକ ଓ ଉତ୍ପାଦଗୁଡ଼ିକରେ ଥିବା ପ୍ରତ୍ୟେକ ମୌଳିକର ପରମାଣୁ ସଂଖ୍ୟାର ଏକ ତାଲିକା ପ୍ରସ୍ତୁତ କରାଯାଉ ।
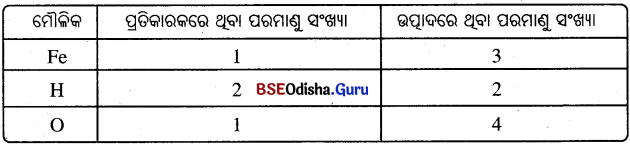
ସୋପାନ – 3 :
- ସାଧାରଣତଃ ପ୍ରତିକାରକ କିମ୍ବା ଉତ୍ପାଦରେ ଯେଉଁ ଯୌଗିକରେ ସର୍ବାଧିକ ସଂଖ୍ୟକ ପରମାଣୁ ଥାଏ, ସେହି ଯୌଗିକର ପରମାଣୁଗୁଡ଼ିକୁ ପ୍ରଥମେ ସମତୁଲ କରିବା ସୁବିଧାଜନକ ହୋଇଥାଏ ।
- ଏହି ପଦ୍ଧତି ଅବଲମ୍ବନ କରି ଯୌଗିକ Fe3O4 ରେ ମୌଳିକ ଅକ୍ସିଜେନ (O)କୁ ବାଛିବା ।
- ଦକ୍ଷିଣ ପାର୍ଶ୍ଵରେ ଚାରୋଟି ଅକ୍ସିଜେନ ପରମାଣୁ ଓ ବାମପାର୍ଶ୍ଵରେ କେବଳ ଗୋଟିଏ ଅକ୍ସିଜେନ ପରମାଣୁ ଅଛି । ତେଣୁ ବାମପାର୍ଶ୍ଵରେ H2Oକୁ 4 ଦ୍ବାରା ଗୁଣାଯାଏ । ଅକ୍ସିଜେନ ପରମାଣୁଗୁଡ଼ିକୁ ସମତୁଲ କରିବାକୁ :
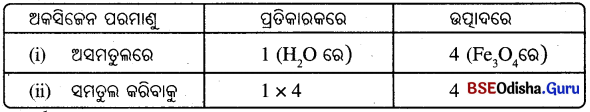
- ବର୍ତ୍ତମାନ ଆଂଶିକ ଭାବରେ ସମତୁଲ ହୋଇଥିବା ସମୀକରଣଟି ହେବ
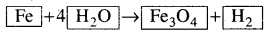
ସୋପାନ -4 :
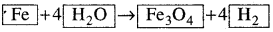
- ବର୍ତ୍ତମାନ ସୁଦ୍ଧା Fe ଓ H ର ପରମାଣୁ ସମତୁଲ ହୋଇପାରି ନାହିଁ । ଏହି ଦୁଇଟି ମୌଳିକ ମଧ୍ୟରୁ ଯେ କୌଣସି ଗୋଟିଏକୁ ବାଛି ସମତୁଲ ପ୍ରକ୍ରିୟାକୁ ଆଗେଇ ନେବାକୁ ହେବ ।
- H ପରମାଣୁକୁ ତୀର ଚିହ୍ନର ଉଭୟ ପାର୍ଶ୍ଵରେ ସମାନ କରିବା ପାଇଁ, ଦକ୍ଷିଣ ପାର୍ଶ୍ଵରେ ଥିବା H, ଅଣୁକୁ4 ଦ୍ଵାରା ଗୁଣନ କରାଯାଉ ।
- ବର୍ତ୍ତମାନ ସମୀକରଣଟି ହେବ :
ସୋପାନ- 5 :
- ତୃତୀୟ ମୌଳିକ Fe ଏ ପର୍ଯ୍ୟନ୍ତ ସମତୁଲ ହୋଇନାହିଁ ।
- Fe କୁ ସମାନ କରିବା ପାଇଁ ଆମେ ତିନୋଟି Fe ପରମାଣୁ ବାମପାର୍ଶ୍ବରେ ନେବା । ତେଣୁ ବାମପାର୍ଶ୍ଵର Feକୁ 3 ଦ୍ଵାରା ଗୁଣାଯାଉ ।

- ବର୍ତ୍ତମାନ ସମତୁଲ ସମୀକରଣଟି ହେବ :
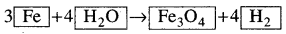
ସୋପାନ- 6 :
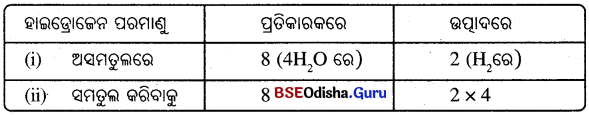
(i) ସମୀକରଣର ଉଭୟ ପାର୍ଶ୍ଵରେ ମୌଳିକଗୁଡ଼ିକର ପରମାଣୁ ସଂଖ୍ୟା ସମାନ ହୋଇଯାଇଛି । ତେଣୁ ସମୀକରଣଟି ସମତୁଲ ହୋଇଯାଇଛି । ବାକ୍ସଗୁଡ଼ିକୁ ଉଠାଇଦେଲେ ନିମ୍ନଲିଖ୍ ସମତୁଲ ରାସାୟନିକ ସମୀକରଣ ମିଳିବ :
3Fe + 4H2O → Fe3O4 + 4H2
(ii) ସମୀକରଣକୁ ସମତୁଲ କରିବା ପାଇଁ ପ୍ରତ୍ୟେକ ସୋପାନରେ ଏକ ନିର୍ଦ୍ଦିଷ୍ଟ ମୌଳିକର ପରମାଣୁ ସଂଖ୍ୟାକୁ ଉଭୟ ପାର୍ଶ୍ଵରେ ସମାନ କରାଯାଉ । ସମତୁଲ କରିବାର ଏହି ପଦ୍ଧତିକୁ ପରଖ-ନିରେଖ (Hit and Trial) ପଦ୍ଧତି କୁହାଯାଏ ।
![]()
ସୋପାନ – 7 :
→ ଭୌତିକ ଅବସ୍ଥା ପାଇଁ ପ୍ରତୀକର ସୂଚନା (Writing Symbols of Physical States) :
- ରାସାୟନିକ ସମୀକରଣକୁ ଅଧିକ ତଥ୍ୟମୂଳକ କରିବା ପାଇଁ ପ୍ରତିକାରକ ଓ ଉତ୍ପାଦଗୁଡ଼ିକରେ ରାସାୟନିକ ସଂକେତ ଲେଖାଯିବା ସହିତ ସେମାନଙ୍କର ଭୌତିକ ଅବସ୍ଥାଗୁଡ଼ିକ ଉଲ୍ଲେଖ କରାଯାଏ ।
- ପ୍ରତିକାରକ ଓ ଉତ୍ପାଦଗୁଡ଼ିକର ଗ୍ୟାସୀୟ ଅବସ୍ଥା ପାଇଁ (g), ତରଳ ଅବସ୍ଥା ପାଇଁ (I), କଠିନ ଅବସ୍ଥା ପାଇଁ (s) ଓ ଜଳୀୟ ଦ୍ରବଣ ପାଇଁ (aq) ସଂକେତ ଦ୍ୱାରା ସୂଚାଇ ଦିଆଯାଏ ।
- ଯଦି ପ୍ରତିକାରକ କିମ୍ବା ଉତ୍ପାଦ ଜଳରେ ଦ୍ରବୀଭୂତ ହୋଇଥାଏ, ତେବେ ସେହି ଦ୍ରବଣ ପାଇଁ ଆକ୍ସ୍ (aqueous, aq) ଶବ୍ଦ ବ୍ୟବହାର କରାଯାଏ ।
ପ୍ରତିକାରକ ଓ ଉତ୍ପାଦଗୁଡ଼ିକର ଭୌତିକ ଅବସ୍ଥା ଦର୍ଶାଯାଇ ସମତୁଲ ସମୀକରଣଟି ହେବ ।
3Fe(s) + 4H2O(g) → Fe3O4(s) + 4H2(g) - ବେଳେବେଳେ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ସମ୍ପାଦନ ପାଇଁ ତାପ, ଚାପ, ଉତ୍ପ୍ରେରକ ଇତ୍ୟାଦି ଭଳି ପ୍ରତିକ୍ରିୟାର ସର୍ଭଗୁଡ଼ିକୁ ସମୀକରଣ ମଧ୍ୟସ୍ଥ ତୀର ଚିହ୍ନ ଉପରେ କିମ୍ବା ତଳେ ଦର୍ଶାଯାଇଥାଏ ।
ଉଦାହରଣ ସ୍ଵରୂପ :
→ ବିଭିନ୍ନ ପ୍ରକାର ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା (Types of Chemical Reactions):
ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ପ୍ରତିକାରକଗୁଡ଼ିକର ପରମାଣୁଗୁଡ଼ିକ ମଧ୍ୟରେ ଥିବା ବନ୍ଧଗୁଡ଼ିକ ଭାଙ୍ଗିଯାଏ ଏବଂ ଉତ୍ପାଦର ପରମାଣୁଗୁଡ଼ିକ ମଧ୍ୟରେ ନୂତନ ବନ୍ଧ ସୃଷ୍ଟି ହୋଇଥାଏ । ରାସାୟନିକ ବନ୍ଧକୁ ଭାଙ୍ଗିବାରେ ଶକ୍ତି ଆବଶ୍ୟକ ହୋଇଥାଏ । ଏଥିରେ ଶକ୍ତିରେ ପରିବର୍ତ୍ତନ ଘଟିଥାଏ ।
ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ସମୟରେ ଶକ୍ତି ନିର୍ଗତ କିମ୍ବା ଶୋଷିତ ହୋଇଥାଏ । ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ଘଟାଇବା ପାଇଁ ଆବଶ୍ୟକୀୟ ଶକ୍ତି, ଚାପ, ତାପ, ଆଲୋକ, ବିଦ୍ୟୁତ୍ ଶକ୍ତି ଯୋଗାଇ ଦିଆଯାଇଥାଏ ।
ବିଭିନ୍ନ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାଗୁଡ଼ିକ ହେଲା :
(A) ସଂଶ୍ଳେଷଣ ପ୍ରତିକ୍ରିୟା (Combination Reaction)
(B) ରିଘଗନ ପ୍ରତିକ୍ରପ୍ରା (Decomposition Reaction)
(C) ବିସ୍ଥାପନ ପ୍ରତିକ୍ରସ୍ରା (Displacement Reaction)
(D) ଦ୍ୱେତ ବିସ୍ଥାପନ ପ୍ରତିକୃପ୍ରା (Double Displacement Reaction)
→ (A) ସଂଶ୍ଳେଷଣ ପ୍ରତିକ୍ରିୟା (Combination of Reaction):
ଯେଉଁ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ଦୁଇ ବା ଅଧ୍ବକ ମୌଳିକ କିମ୍ବା ଯୌଗିକ ପ୍ରତିକାରକ ପାର୍ଶ୍ବରେ ସଂଯୁକ୍ତ ହୋଇ ଗୋଟିଏ ମାତ୍ର ଯୌଗିକ ଉତ୍ପାଦ ପାର୍ଶ୍ବରେ ଉତ୍ପନ୍ନ ହୁଏ, ସେହି ପ୍ରତିକ୍ରିୟାକୁ ସଂଶ୍ଳେଷଣ ପ୍ରତିକ୍ରିୟା କୁହାଯାଏ ।
→ ତାପ ଉତ୍ପାଦୀ ବା ତାପ ଉତ୍ପାଦକ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା (Exothermic Chemical Reaction) :
ଯେଉଁ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ଉତ୍ପାଦ ଉତ୍ପନ୍ନ ହେବା ସଙ୍ଗେ ସଙ୍ଗେ ତାପ ନିର୍ଗତ ହୋଇଥାଏ, ତାହାକୁ ତାପ ଉତ୍ପାଦୀ ବା ତାପ ଉତ୍ପାଦକ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା କୁହାଯାଏ ।
ଡ୍ତାହରଣ :
(i) କ୍ୟାଲସିୟମ୍ ଅକ୍ସାଇଡ୍ ଜଳ ସହିତ ତୀବ୍ର ପ୍ରତିକ୍ରିୟା ଘଟି ପ୍ରଚୁର ପରିମାଣର ତାପ ନିର୍ଗତ ହେବା ସଙ୍ଗେ ସଙ୍ଗେ ଶର୍ମିତ ଚୂନ ବା କ୍ୟାଲସିୟମ୍ ହାଇଡ୍ରୋକସାଇଡ୍ ଉତ୍ପନ୍ନ ହୋଇଥାଏ ।
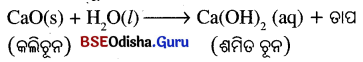
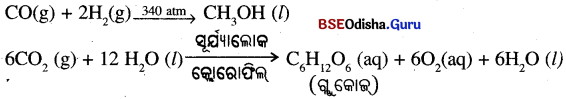
(ii) ପ୍ରାକୃତିକ ଗ୍ୟାସ୍ ଦହନ ଫଳରେ ଅଙ୍ଗାରକାମ୍ଳ ଓ ଜଳୀୟବାଷ୍ପ ସୃଷ୍ଟି ହେବା ସହିତ ପ୍ରଚୁର ତାପଶକ୍ତି ନିର୍ଗତ ହୋଇଥାଏ ।
CH4(g) + 202(g) → CO2(g) + 2H2O (g) + ଚାପ
(ii) ଶ୍ଵାସକ୍ରିୟା ବା ଶ୍ୱସନ ପ୍ରକ୍ରିୟା ମଧ୍ୟ ଏକ ତାପ ଉତ୍ପାଦୀ ପ୍ରତିକ୍ରିୟା ଅଟେ । ପରିପାକ ପ୍ରକ୍ରିୟା (Digestion)ରେ ଖାଦ୍ୟ ସରଳତର ପଦାର୍ଥରେ ପରିଣତ ହୁଏ । ଭାତ, ରୁଟି, ଆଳୁ ଇତ୍ୟାଦି ଶ୍ଵେତସାର (Carbohydrate) ଜାତୀୟ ଖାଦ୍ୟରୁ ଗ୍ଲୁକୋଜ୍ (C6H12O6) ସୃଷ୍ଟି ହୁଏ । ଗ୍ଲୁକୋଜ୍ ଆମ ଶରୀରର ଜୀବକୋଷ ମଧ୍ୟରେ ଥିବା ଅକ୍ସିଜେନ ସହିତ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା କରେ ଏବଂ ଶରୀରକୁ ଶକ୍ତି ଯୋଗାଇଥାଏ । ଏହି ପ୍ରତିକ୍ରିୟାର ଏକ ସ୍ବତନ୍ତ୍ର ନାମ ହେଉଛି ଶ୍ବସନ ପ୍ରକ୍ରିୟା (Respiration) ।
C6H12O6(aq) + 6O2(aq) — 6CO2(aq) + 6H2O(l) + ଚାପ
(iv) ଉଭିଦଜାତ ଦ୍ରବ୍ୟର ବିଘଟନ ହୋଇ ଖତରେ ପରିଣତ ହେବା ।
→ (B) ବିଘଟନ ପ୍ରତିକ୍ରିୟା (Decomposition Reaction):
ଯେଉଁ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ଗୋଟିଏ ମାତ୍ର ଯୌଗିକ ବିଘଟିତ ହୋଇ ଦୁଇ ବା ଅଧିକ ସରଳତର ଉତ୍ପାଦ ସୃଷ୍ଟି କରେ, ତାହାକୁ ବିଘଟନ ପ୍ରତିକ୍ରିୟା କୁହାଯାଏ ।
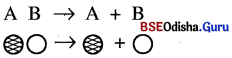
ବିଘଟନ ପ୍ରତିକ୍ରିୟା ହେଉଛି ସଂଶ୍ଳେଷଣ ପ୍ରତିକ୍ରିୟାର ବିପରୀତ ।
ବିଘଟନ ପ୍ରତିକ୍ରିୟା ତିନି ପ୍ରକାର; ଯଥା – ତାପୀୟ ବିଘଟନ, ବୈଦ୍ୟୁତିକ ବିଘଟନ ଓ ଆଲୋକ ରାସାୟନିକ ବିଘଟନ ।
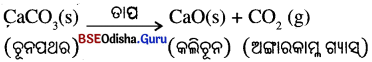
ତାପୀୟ ବିଘଟନ :
ଯେଉଁ ପ୍ରତିକ୍ରିୟାରେ ଏକ ଯୌଗିକ ତାପ ପ୍ରୟୋଗଦ୍ଵାରା ବିଘଟିତ ହୋଇ ଦୁଇ ବା ତହିଁରୁ ଅଧିକ ସରଳତର ଉତ୍ପାଦରେ ପରିଣତ ହୁଏ, ତାହାକୁ ‘ତାପୀୟ ବିଘଟନ’ (Thermal Decomposition) କୁହାଯାଏ । ଉଦାହରଣ: ତାପ ପ୍ରୟୋଗ ହେତୁ କ୍ୟାଲସିୟମ୍ କାର୍ବୋନେଟ୍ର ବିଘଟନ ଘଟି କ୍ୟାଲସିୟମ୍ ଅକ୍ସାଇଡ୍ ଓ କାର୍ବନ ଡାଇଅକ୍ସାଇଡ୍ ସୃଷ୍ଟି ହୁଏ ।
→ ବୈଦ୍ୟୁତିକ ବିଘଟନ (Electrolytic Decomposition) :
‘‘ଯେଉଁ ପ୍ରତିକ୍ରିୟାରେ ଏକ ଯୌଗିକର ଜଳୀୟ ଦ୍ରବଣରେ କିମ୍ବା ତରଳାବସ୍ଥାର ବିଦ୍ୟୁତ୍ ସ୍ରୋତଦ୍ୱାରା ବିଘଟିତ ହୋଇଥାଏ, ତାହାକୁ ବୈଦ୍ୟୁତିକ ବିଘଟନ ବା ବୈଦ୍ୟୁତିକ ବିଶ୍ଳେଷଣ କୁହାଯାଏ ।’’
ଆଲୋକ ରାସାୟନିକ ବିଘଟନ (Photo – Chemical Decomposition) :
‘‘ଯେଉଁ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ଗୋଟିଏ ଯୌଗିକ ଆଲୋକ ଶକ୍ତିଦ୍ୱାରା ବିଘଟିତ ହୁଏ, ତାହାକୁ ଆଲୋକ ରାସାୟନିକ ବିଘଟନ କୁହାଯାଏ ।
→ ତାପଶୋଷୀ ବା ତାପଗ୍ରାହୀ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା (Endothermic Chemical reaction ):
ବିଘଟନ ପ୍ରତିକ୍ରିୟାରେ ପ୍ରତିକାରକଗୁଡ଼ିକର ବିଘଟନ ପାଇଁ ତାପ, ଆଲୋକ କିମ୍ବା ବିଦ୍ୟୁତ୍ ଶକ୍ତି ଆବଶ୍ୟକ ହୋଇଥାଏ । ଯେଉଁ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ତାପଶକ୍ତି ଶୋଷିତ ହୋଇଥାଏ, ତାହାକୁ ‘‘ତାପଶୋଷୀ ବା ତାର୍ପଗ୍ରାହୀ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା’’ କୁହାଯାଏ ।
![]()
ଡ୍ତାହରଣ :
ଏକ ପରୀକ୍ଷାନଳୀରେ 2 ଗ୍ରାମ୍ ବେରିୟମ୍ ହାଇଡ୍ରୋକ୍ସାଇଡ୍ ଏବଂ l ଗ୍ରାମ୍ ଏମୋନିୟମ୍ କ୍ଲୋରାଇଡ୍ ମିଶାଇ ଗୋଟିଏ ଗ୍ଲାସ୍ ରଡ୍ରେ ଘାଣ୍ଟିଲେ ପରୀକ୍ଷାନଳୀର ନିମ୍ନଭାଗ ଥଣ୍ଡାଲାଗିବ । ଏହା ଏକ ତାପଶୋଷୀ ପ୍ରତିକ୍ରିୟା ।
ବେରିୟମ ହାଇଡ୍ରୋକ୍ସାଇଡ୍ ସହିତ ଏମୋନିୟମ୍ କ୍ଲୋରାଇଡ୍ ମିଶିଲେ, ତାପଶକ୍ତି ଶୋଷିତ ହୋଇଥାଏ ଏବଂ ଅନ୍ୟାନ୍ୟ ଯୌଗିକମାନ ସୃଷ୍ଟି ହୁଏ ।
Ba (OH)2 + 2 NH4Cl → 2NH4OH + BaCl2 ତାପ
→ (c) ବିସ୍ଥାପନ ପ୍ରତିକ୍ରିୟା (Displacement Reaction):
ଯେଉଁ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ଗୋଟିଏ ମୌଳିକ କୌଣସି ଏକ ଯୌଗିକର ମୌଳିକକୁ ଅପସାରଣ ବା ବିସ୍ଥାପନ କରେ, ସେହି ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାକୁ ବିସ୍ଥାପନ ପ୍ରତିକ୍ରିୟା କୁହାଯାଏ ।
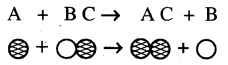
‘A’ ମୌଳିକଟି BC ଯୌଗିକରୁ ‘B’କୁ ଅପସାରଣ କରିଥାଏ ।
ଡ୍ତାହରଣ :
ଆଇରନ୍ କିପର ସଲଫେଟ୍ ଜଳୀୟ ଦ୍ରବଣ ସହ ପ୍ରତିକ୍ରିୟା କରି ଆଇରନ୍ ସଲ୍ଫେଟ୍ ଓ କପର ସୃଷ୍ଟି ହୁଏ । ଏହି ପ୍ରତିକ୍ରିୟାରେ ଆଇରନ୍ କପର ସଲ୍ଫେଟ୍ରର ଜଳୀୟ ଦ୍ରବଣରୁ Cutକୁ ବିସ୍ଥାପିତ କରେ ।
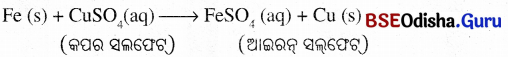
ପ୍ରେହିପରି

ଜିଙ୍କ୍ ଓ ଲେଡ୍ କପର ଠାରୁ ଅଧିକ ପ୍ରତିକ୍ରିୟାଶୀଳ ମୌଳିକ ହୋଇଥିବାରୁ ସେମାନେ କପର ଯୌଗିକରୁ କପର ଅପସାରଣ କରନ୍ତି ।
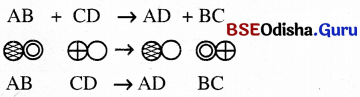
→ (D) goal (Double Displacement Reaction):
‘‘ଯେଉଁ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାରେ ପ୍ରତିକାରକ ଦ୍ବୟ ମଧ୍ୟରେ ଆୟନ ବିନିମୟ ଘଟିଥାଏ, ସେହି ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାକୁ ଦ୍ୱୈତ ବିସ୍ଥାପନ ପ୍ରତିକ୍ରିୟା କୁହାଯାଏ ।’’
ଦ୍ୱୈତ ବିସ୍ଥାପନ ପ୍ରତିକ୍ରିୟାକୁ ନିମ୍ନମତେ ଅନୁଧ୍ୟାନ କରାଯାଇ ଉକ୍ତ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାକୁ ଅନୁଶୀଳନ କରାଯାଏ ।
ଉଦାହରଣ :
(i) ସିଲ୍ଭର୍ ନାଇଟ୍ରେଟ୍ର ଜଳୀୟ ଦ୍ରବଣକୁ ସୋଡ଼ିୟମ୍ କ୍ଲୋରାଇଡ଼ର ଜଳୀୟ ଦ୍ରବଣ ସହ ପ୍ରତିକ୍ରିୟା ଘଟାଇଲେ ସିଲଭର୍ କ୍ଲୋରାଇଡ୍ସର ଧଳା ଅଧଃକ୍ଷେପ ସୃଷ୍ଟି ହୁଏ ।
AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
(ii) ବେରିୟମ୍ କ୍ଲୋରାଇଡ୍ସର ଜଳୀୟ ଦ୍ରବଣକୁ ଲଘୁ ଗନ୍ଧକାମ୍ଳ ସହ ପ୍ରତିକ୍ରିୟା ଘଟାଇଲେ ବେରିୟମ୍ ସଲ୍ଫେଟ୍ର ଧଳା ଅଧଃକ୍ଷେପ ସୃଷ୍ଟି ହୁଏ ।
BaCl2(aq) + H2SO4(aq) → BaSO4(s) + 2HCl (aq)
![]()
→ ଜାରଣ (Oxidation) :
ଯେଉଁ ପ୍ରକ୍ରିୟାରେ ଅକ୍ସିଜେନ୍ର ଯୋଗ ଓ ହାଇଡ୍ରୋଜେନ୍ର ବିଯୋଗ ଘଟିଥାଏ, ତାହାକୁ ଜାରଣ କୁହାଯାଏ ।
ଉଦାହରଣ :
ଅମ୍ଳଜାନର ଯୋଗ (Addition of Oxygen):
(i) ଅମ୍ଳଜାନର ଉପସ୍ଥିତିରେ କାର୍ବନର ଦହନ ଘଟିଲେ ଅଙ୍ଗାରକାମ୍ଳ ଗ୍ୟାସ୍ ସୃଷ୍ଟି ହୁଏ ।.
C(s) + O2 (g) → CO2(g)
(ii) ମ୍ୟାଗ୍ନେସିୟମ୍ର ଅମ୍ଳଜାନ ଉପସ୍ଥିତିରେ ଦହନ ଘଟିଲେ କଠିନ ମ୍ୟାଗ୍ନେସିୟମ୍ ଅକ୍ସାଇଡ୍ ସୃଷ୍ଟି ହୁଏ ।
2Mg(s) + O2(g) → 2MgO(s)
(iii) ଆର୍ଦ୍ର ବାୟୁରେ ଅମ୍ଳଜାନ ସହ ଲୁହାର ପ୍ରତିକ୍ରିୟା ଘଟିଲେ ସେଥିରେ କଳଙ୍କି ସୃଷ୍ଟି ହୁଏ ।
4Fe(s) + 3O2(g) + H2O(g) → 2Fe2O3 . H2O
→ (b) ହାଇଡ୍ରୋଜେନ୍ର ବିୟୋଗ (Removal of Hydrogen) :
(i) ବ୍ରୋମିନ୍ ହାଇଡ୍ରୋଜେନ୍ ସଲ୍ଫାଇଡ୍ ସହ ପ୍ରତିକ୍ରିୟା କଲେ ହାଇଡ୍ରୋଜେନ୍ ବ୍ରୋମାଇଡ୍ ଓ ସଲ୍ଫର୍ ସୃଷ୍ଟି ହୁଏ । ଏହି ପ୍ରତିକ୍ରିୟାରେ ହାଇଡ୍ରୋଜେନ୍ ସଲ୍ଫାଇଡ଼ରୁ ହାଇଡ୍ରୋଜେନ୍ର ବିୟୋଗ ଘଟିଥାଏ ।
H2S(aq) + Br2(aq) → 2HBr(aq) + S
(iii) ଉକ୍ତ ପରିବେଶରେ ମାଙ୍ଗାନିଜ୍ ଡାଇଅକ୍ସାଇଡ୍ର ଲଘୁ ଲବଣାମ୍ଳ ସହ ପ୍ରତିକ୍ରିୟା ଘଟିଲେ ମାଙ୍ଗାନିଜ୍ କ୍ଲୋରାଇଡ୍, ଜଳ ଓ କ୍ଲୋରିନ୍ ଗ୍ୟାସ୍ ସୃଷ୍ଟି ହୁଏ ।
4HC/ (aq) + MnO2(s) → MnCl2(aq) + 2H2O(l) + 2Cl2(g)
ବିଜାରଣ (Reduction) :
ଯେଉଁ ପ୍ରତିକ୍ରିୟାରେ ହାଇଡ୍ରୋଜେନ୍ର ଯୋଗ ଓ ଅକ୍ସିଜେନ୍ର ବିଯୋଗ ଘଟିଥାଏ, ତାହାକୁ ବିଜାରଣ କୁହାଯାଏ ।
ଉଦାହରଣ :
ହାଇଡ୍ରୋଜେନ୍ର ଯୋଗ (Addition of Hydrogen) :
(i) ହାଇଡ୍ରୋଜେନ୍ ଗ୍ୟାସର ସଲ୍ଫର୍ ସହ ପ୍ରତିକ୍ରିୟା ଘଟିଲେ ହାଇଡ୍ରୋଜେନ୍ ସଲ୍ଫାଇଡ୍ ସୃଷ୍ଟି ହୁଏ ।
H2(g) + S(g) → H2S(g)
(ii) ଜଳୀୟ ହାଇଡ୍ରୋଜେନ୍ ସଲ୍ଫାଇଡ୍ର କ୍ଲୋରିନ୍ ଗ୍ୟାସ୍ ସହ ପ୍ରତିକ୍ରିୟା ଘଟିଲେ ଲବଣାମ୍ଳ ଓ ସଲ୍ଫର୍ ସୃଷ୍ଟି ହୁଏ ।
H2S (aq) + Cl2(g) → 2HCI (ag) + S(s)
(b) ଅକ୍ସିଜେନର ରିପୋଟ (Removal of Oxygen) :
(i) ହାଇଡ୍ରୋଜେନ୍ ଗ୍ୟାସ୍କୁ ଉତ୍ତପ୍ତ କପର୍ ଅକ୍ସାଇଡ଼ ଉପରେ ପ୍ରବାହିତ କଲେ, ଏହା ଧାତବ କପରକୁ ବିଜାରିତ ହୁଏ ।
![]()
(ii) କାର୍ବନ ମନୋକ୍ସାଇଡ଼କୁ ଉତ୍ତପ୍ତ ଫେରିକ୍ ଅକ୍ସାଇଡ୍ ଉପରେ ପ୍ରବାହିତ କଲେ, ଏହା ଧାତବ ଲୁହାକୁ ବିଜାରିତ ହୁଏ ।
![]()
![]()
→ ଜାରକ (Oxidising Agent) :
ଯେଉଁ ପଦାର୍ଥ ଅକ୍ସିଜେନ୍ ଦେଇ କିମ୍ବା ହାଇଡ୍ରୋଜେନ୍ ନେଇ ଅନ୍ୟ ପଦାର୍ଥର ଜାରଣ ଘଟାଇଥାଏ, ତାହାକୁ ଜାରକ କୁହାଯାଏ ।
ଉଦାହରଣ :
(i) C(s) + O2(g) → CO2(g)
ଉପରୋକ୍ତ ପ୍ରତିକ୍ରିୟାରେ କାର୍ବନ୍ କାର୍ବନ ଡାଇଅକ୍ସାଇଡ୍କୁ ଜାରିତ ହେଉଥିବାରୁ ଅକ୍ସିଜେନ୍ ଏକ ଜାରକ ଅଟେ ।
(ii) H2S(aq) + Cl2(g) → 2HCl (aq) + S(s)
ଉପରୋକ୍ତ ପ୍ରତିକ୍ରିୟାରେ ହାଇଡ୍ରୋଜେନ୍ ସଲ୍ଫାଇଡ୍ କ୍ଲୋରିନ୍ଦ୍ୱାରା ଜାରିତ ହେଉଥିବାରୁ କ୍ଲୋରିନ୍ ଏକ ଜାରକ ଅଟେ ।
→ ବିଜାରକ (Reducing Agent) :
ଯେଉଁ ପଦାର୍ଥ ହାଇଡ୍ରୋଜେନ୍ ଦେଇ କିମ୍ବା ଅକ୍ସିଜେନ୍ ନେଇ ଅନ୍ୟ ପଦାର୍ଥର ବିଜାରଣ ଘଟାଇଥାଏ, ତାକୁ ବିଜାରଣ କୁହାଯାଏ ।
ଉଦାହରଣ :
(i) Cl2(g) + H2S (aq) → 2HCl (aq) S(s)
ଉପରୋକ୍ତ ପ୍ରତିକ୍ରିୟାରେ କ୍ଲୋରିନ୍ ହାଇଡ୍ରୋକ୍ଲୋରିକ୍ ଅମ୍ଳକୁ ବିଜାରିତ ହୋଇଥାଏ ଏବଂ ଏଠାରେ ହାଇଡ୍ରୋଜେନ୍ ସଲ୍ଫାଇଡ଼୍ ବିଜାରକ ଅଟେ ।
(ii) MgO (s) + C(s) → Mg(s) + CO(g)
ଉପରୋକ୍ତ ପ୍ରତିକ୍ରିୟାରେ ମ୍ୟାଗ୍ନେସିୟମ୍ ଅକ୍ସାଇଡ୍ ଧାତବ ମ୍ୟାଗ୍ନେସିୟମ୍କୁ ବିଜାରିତ ହୋଇଥାଏ ଏବଂ ଏଠାରେ କାର୍ବନ ବିଜାରକ ଅଟେ ।
→ ଜାରଣ-ବିଜାରଣ ପ୍ରତିକ୍ରିୟା (Oxidation-reduction Reaction) ବା ବିଜାରଣ-କାରଣ ପ୍ରତିକ୍ରିୟା (Redox Reaction) :
କୌଣସି ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା ଚାଲୁଥିବା ସମୟରେ ଗୋଟିଏ ପ୍ରତିକାରକ ଜାରିତ ହେଉଥିଲେ ଅନ୍ୟ ପ୍ରତିକାରକଟି ବିଜାରିତ ହୁଏ । ଏହି ପ୍ରକାର ରାସାୟନିକ ପ୍ରତିକ୍ରିୟାକୁ ଜାରଣ-ବିଜାରଣ ବା ବିଜାରଣ-ଜାରଣ ପ୍ରତିକ୍ରିୟା କୁହାଯାଏ ।
ଉଦାହରଣ :
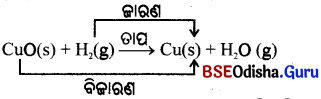
ଉପରୋକ୍ତ ପ୍ରତିକ୍ରିୟାରେ କପର (II) ଅକ୍ସାଇଡ୍ ଧାତବ କପର୍କୁ ବିଜାରିତ ହୋଇଥାଏ ଏବଂ ହାଇଡ୍ରୋଜେନ୍ ଜଳକୁ ଜାରିତ ହୋଇଥାଏ ।
→ ଦୈନଦିନ ଜ1ବନରେ ଜାରଣ ପ୍ରତିକ୍ରିୟାର ପ୍ରଭାବ (Effects of Oxidation reactions in everyday life):
ସଂକ୍ଷାରଣ (Corrosion):
- ଏକ ଲୌହ ନିର୍ମିତ ଦ୍ରବ୍ୟ ନୂତନ ଅବସ୍ଥାରେ ଉଜ୍ଜ୍ବଳ ଓ ମସୃଣ ହୋଇଥାଏ । କିନ୍ତୁ ଏହା କିଛି ଦିନ ବାହାରେ ପଡ଼ିରହିଲେ, ଏହା ଉପରେ ଏକ ଲୋହିତ-ବାଦାମୀ ରଙ୍ଗର ପ୍ରଲେପ ମାଡ଼ିଯାଏ । ଏହି ପ୍ରାକୃତିକ ପ୍ରକ୍ରିୟାକୁ ‘ଲୁହାରେ କଳଙ୍କି ଲାଗିବା’’ କୁହାଯାଏ ।
- ଯେତେବେଳେ ଏକ ଧାତୁ ତାକୁ ଘେରି ରହିଥିବା ଉପାଦାନଗୁଡ଼ିକ (ଯଥା – ଜଳୀୟବାଷ୍ପ, ଅମ୍ଳ ଇତ୍ୟାଦି) ସହିତ ରାସାୟନିକ ପ୍ରତିକ୍ରିୟା କରେ, ସେତେବେଳେ ଧାତୁଟିର ଧୀରେ ଧୀରେ କ୍ଷୟ ଘଟିଥାଏ । ଧାତୁର ଏହି କ୍ଷୟ ହେବା ପ୍ରକ୍ରିୟାକୁ ସଂକ୍ଷାରଣ ବା କ୍ରମକ୍ଷୟ (Corrosion) କୁହାଯାଏ ।
- ସିଲଭର ଉପରେ ପଡ଼ୁଥିବା କଳା ଆସ୍ତରଣ ଓ କପର ଉପରେ ପଡୁଥିବା ସବୁଜ ଆସ୍ତରଣ ହେଉଛି ସଂକ୍ଷାରଣର ଉଦାହରଣ ।
- ସଂକ୍ଷାରଣ ହେତୁ ମଟରଗାଡ଼ି, ପୋଲ, ଲୁହାବାଡ଼, ଜାହାଜ ଏବଂ ଧାତୁ ନିର୍ମିତ ସମସ୍ତ ବସ୍ତୁ ବିଶେଷକରି ଲୌହ ନିର୍ମିତ ବସ୍ତୁଗୁଡ଼ିକର କ୍ଷୟ ଘଟିଥାଏ ।
→ ସଢ଼ା ଅବସ୍ଥା (Rancidity):
- ବହୁତ ଦିନ ଧରି ରହିଯାଇଥିବା ଚର୍ବି ଏବଂ ତେଲ ବାୟୁ ସଂସ୍ପର୍ଶରେ ଆସି ଜାରିତ ହୋଇଥାଏ । ଏହାଫଳରେ ତା’ର ଗନ୍ଧ ଓ ସ୍ବାଦ ବଦଳିଯାଇଥାଏ । ତହିଁରୁ ରହଣିଆ ଗନ୍ଧ ବାହାରୁଥାଏ । ଏହାକୁ ପଦାର୍ଥର ସଢ଼ା ଅବସ୍ଥା କୁହାଯାଏ ।
- ଯେଉଁ ପଦାର୍ଥ ଜାରଣକୁ ନିରୋଧ କରେ ତାକୁ ପ୍ରତିଜାରକ (Antioxidant) କହନ୍ତି । ଖାଦ୍ୟ ସାମଗ୍ରୀରେ ସାଧାରଣତଃ ପ୍ରତିଜାରକକୁ ମିଶାଇ ସେଗୁଡ଼ିକୁ ବହୁଦିନ ପର୍ଯ୍ୟନ୍ତ ସଂରକ୍ଷଣ କରାଯାଇଥାଏ ।
- ବାୟୁରୋଧୀ ପାତ୍ର (Air-tight container)ରେ ଖାଦ୍ୟପଦାର୍ଥ ରଖି ଜାରଣ ପ୍ରକ୍ରିୟା ମନ୍ଥର ହୁଏ । ଏହା ଫଳରେ ସେଗୁଡ଼ିକର ସଂରକ୍ଷଣ ସହଜ ହୋଇଥାଏ ।
